Chemia może wydawać się skomplikowana, ale zrozumienie podstawowych pojęć, takich jak masa atomowa i masa cząsteczkowa, otwiera drzwi do głębszego zrozumienia tego fascynującego świata. Dziś przyjrzymy się im bliżej, krok po kroku, używając prostych przykładów, aby wszystko stało się jasne i zrozumiałe. Zaczynajmy!
Czym jest atom?
Wyobraź sobie, że masz klocki LEGO. Wszystko, co budujesz, składa się z tych małych elementów. W świecie materii, odpowiednikiem klocków LEGO są atomy. Atomy to najmniejsze jednostki pierwiastka chemicznego, które zachowują jego właściwości. Na przykład, atom wodoru jest najmniejszą cząstką wodoru.
Atomy są niesamowicie małe. Gdybyś miał linijkę i próbował zmierzyć atom, nie udałoby się. Potrzebowałbyś specjalistycznego mikroskopu elektronowego, aby go zobaczyć. To tak, jakbyś próbował zobaczyć pojedynczy ziarenko piasku z kosmosu – potrzebujesz odpowiedniego sprzętu.
Masa atomowa - waga pojedynczego klocka
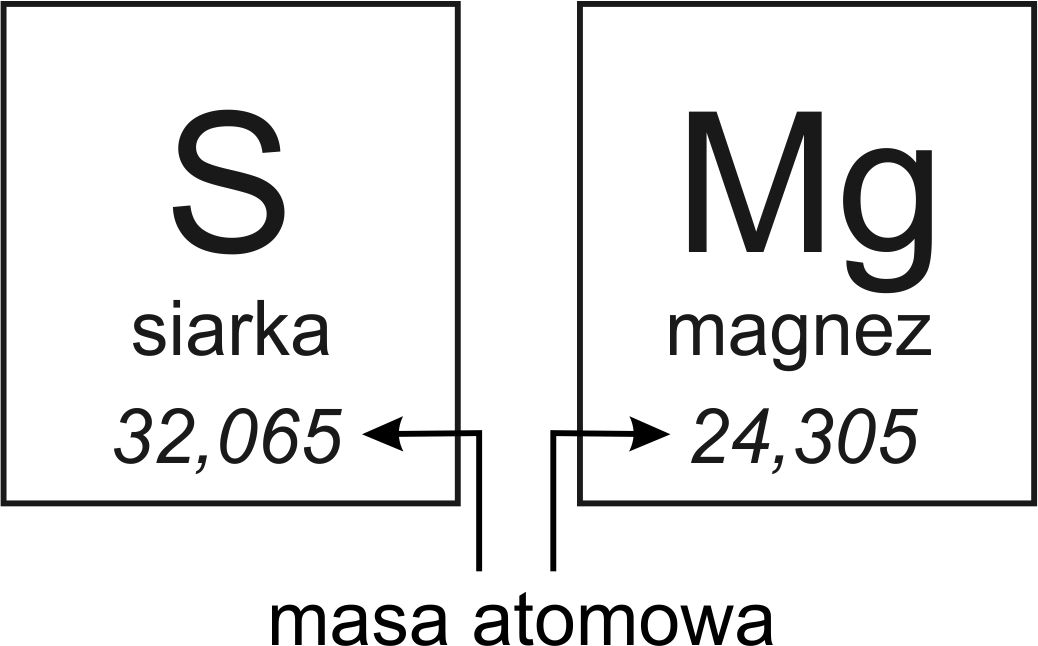
Masa atomowa to w uproszczeniu "waga" pojedynczego atomu. Ponieważ atomy są tak małe, ich masa jest mierzona w specjalnej jednostce – unitach masy atomowej (u), czasem oznaczanych jako daltony (Da). Pomyśl o tym jak o nowej jednostce miary, stworzonej specjalnie dla atomów, podobnie jak kilogram jest używany do ważenia większych obiektów, a gram do mniejszych. Jeden unit masy atomowej (1 u) jest zdefiniowany jako 1/12 masy atomu węgla-12.
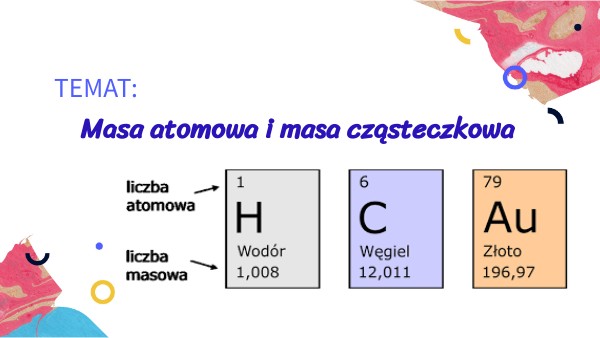
Zamiast mówić, że atom waży np. 0,000000000000000000000001 grama (co jest niewygodne), używamy jednostki 'u'. Na przykład, atom wodoru (H) ma masę atomową około 1 u. Atom tlenu (O) ma masę atomową około 16 u. To oznacza, że atom tlenu jest około 16 razy "cięższy" od atomu wodoru. Wartości mas atomowych znajdziesz w układzie okresowym pierwiastków.
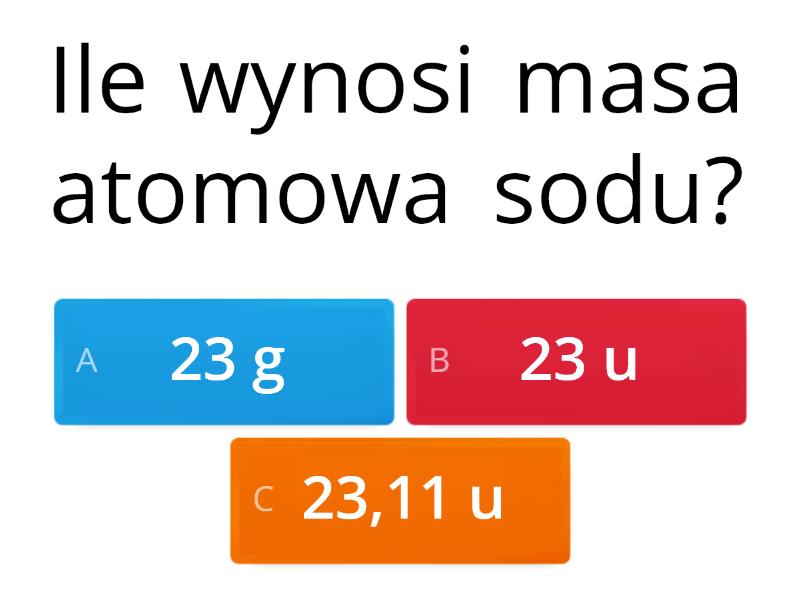
Gdzie znaleźć te wartości? Najprościej w układzie okresowym pierwiastków! Pod każdym symbolem pierwiastka znajduje się liczba, która reprezentuje jego średnią masę atomową. Na przykład, pod symbolem sodu (Na) znajdziesz liczbę około 23 u. Ta liczba uwzględnia istnienie izotopów, o których za chwilę.
Izotopy i średnia masa atomowa
Czasami atomy tego samego pierwiastka mogą mieć różną liczbę neutronów w jądrze. Te różne wersje tego samego pierwiastka nazywamy izotopami. Izotopy mają taką samą liczbę protonów, ale różną liczbę neutronów. To jakbyś miał klocki LEGO w różnych kolorach, ale nadal byłyby to te same klocki.
Na przykład, węgiel występuje głównie jako węgiel-12 (12C), który ma 6 protonów i 6 neutronów. Ale istnieje też węgiel-14 (14C), który ma 6 protonów i 8 neutronów. Węgiel-14 jest izotopem węgla. Kiedy mówimy o masie atomowej węgla w układzie okresowym, to mamy na myśli średnią masę atomową, która uwzględnia występowanie różnych izotopów w przyrodzie i ich obfitość. Stąd, masa atomowa węgla to około 12,01 u, a nie dokładnie 12 u.
Cząsteczki - budowle z atomów
Atomy rzadko występują w pojedynkę. Zazwyczaj łączą się ze sobą, tworząc cząsteczki. Cząsteczka to grupa dwóch lub więcej atomów połączonych ze sobą wiązaniami chemicznymi. Pomyśl o tym jak o zbudowanej konstrukcji z klocków LEGO. Na przykład, cząsteczka wody (H2O) składa się z dwóch atomów wodoru i jednego atomu tlenu.
Inne przykłady cząsteczek to: tlen (O2), który składa się z dwóch atomów tlenu, dwutlenek węgla (CO2), który składa się z jednego atomu węgla i dwóch atomów tlenu, czy glukoza (C6H12O6), która jest cukrem prostym i ma skomplikowaną strukturę z 6 atomów węgla, 12 atomów wodoru i 6 atomów tlenu.
Masa cząsteczkowa - waga całej budowli
Masa cząsteczkowa to suma mas atomowych wszystkich atomów wchodzących w skład danej cząsteczki. To jakbyś chciał zważyć całą konstrukcję LEGO, znając wagę każdego klocka. Podobnie jak masa atomowa, masa cząsteczkowa jest również wyrażana w unitach masy atomowej (u).
Aby obliczyć masę cząsteczkową, potrzebujesz znać wzór chemiczny danej cząsteczki i masy atomowe poszczególnych pierwiastków, które ją tworzą. Następnie dodajesz masy atomowe wszystkich atomów we wzorze. To bardzo proste, jak tylko zrozumiesz zasadę!
Przykłady obliczania masy cząsteczkowej
Przykład 1: Woda (H2O)
Wzór chemiczny wody to H2O, co oznacza, że cząsteczka wody składa się z dwóch atomów wodoru (H) i jednego atomu tlenu (O).
* Masa atomowa wodoru (H) ≈ 1 u * Masa atomowa tlenu (O) ≈ 16 u Zatem masa cząsteczkowa wody wynosi: (2 x 1 u) + 16 u = 18 uPrzykład 2: Dwutlenek węgla (CO2)
Wzór chemiczny dwutlenku węgla to CO2, co oznacza, że cząsteczka dwutlenku węgla składa się z jednego atomu węgla (C) i dwóch atomów tlenu (O).
* Masa atomowa węgla (C) ≈ 12 u * Masa atomowa tlenu (O) ≈ 16 u Zatem masa cząsteczkowa dwutlenku węgla wynosi: 12 u + (2 x 16 u) = 12 u + 32 u = 44 uPrzykład 3: Glukoza (C6H12O6)
Wzór chemiczny glukozy to C6H12O6, co oznacza, że cząsteczka glukozy składa się z sześciu atomów węgla (C), dwunastu atomów wodoru (H) i sześciu atomów tlenu (O).
* Masa atomowa węgla (C) ≈ 12 u * Masa atomowa wodoru (H) ≈ 1 u * Masa atomowa tlenu (O) ≈ 16 u Zatem masa cząsteczkowa glukozy wynosi: (6 x 12 u) + (12 x 1 u) + (6 x 16 u) = 72 u + 12 u + 96 u = 180 uJak widzisz, obliczanie masy cząsteczkowej to prosta operacja dodawania, jeśli tylko znasz wzór chemiczny i masy atomowe poszczególnych pierwiastków. Praktyka czyni mistrza! Spróbuj obliczyć masę cząsteczkową innych popularnych związków, takich jak sól kuchenna (NaCl) czy amoniak (NH3).
Podsumowanie
Masa atomowa to masa pojedynczego atomu wyrażona w unitach masy atomowej (u). Masa cząsteczkowa to suma mas atomowych wszystkich atomów wchodzących w skład danej cząsteczki, również wyrażona w unitach masy atomowej (u). Zrozumienie tych dwóch pojęć jest kluczowe do dalszej nauki chemii i zrozumienia procesów, które zachodzą wokół nas. Mam nadzieję, że teraz wszystko jest bardziej jasne!