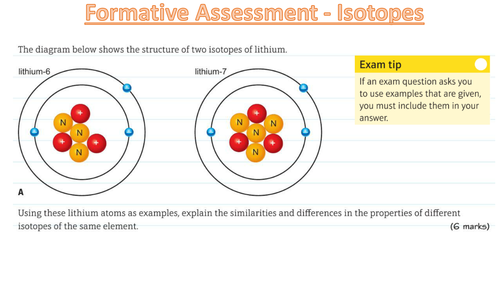
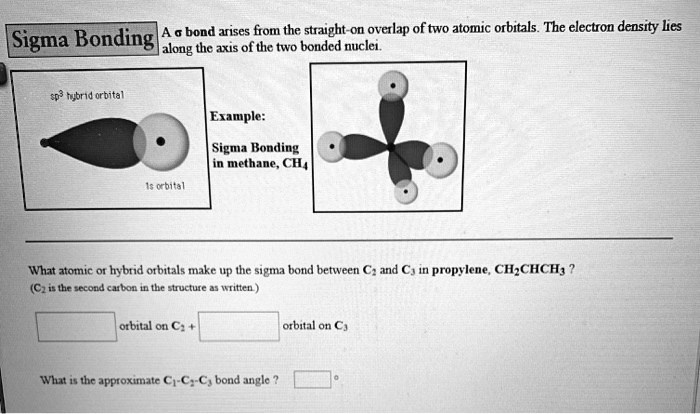
Hej! Przygotowujesz się do sprawdzianu z łączenia się atomów i równań reakcji chemicznych? Świetnie! Razem damy radę.
Łączenie się Atomów
Atomy łączą się, aby uzyskać bardziej stabilną konfigurację elektronową. Pamiętaj o oktecie! Większość atomów dąży do posiadania 8 elektronów na zewnętrznej powłoce.
Rodzaje Wiązań
Istnieją różne rodzaje wiązań chemicznych. Każde ma swoje własności.
Wiązanie Kowalencyjne
Wiązanie kowalencyjne powstaje, gdy atomy dzielą się elektronami. Dzieje się tak między atomami niemetali.
Może być spolaryzowane lub niespolaryzowane. W wiązaniu spolaryzowanym elektrony są przesunięte w stronę bardziej elektroujemnego atomu.
Wiązanie Jonowe
Wiązanie jonowe powstaje, gdy atom oddaje elektron innemu atomowi. Powstają wtedy jony: kation (jon dodatni) i anion (jon ujemny).
To wiązanie typowe dla metali i niemetali. Zazwyczaj tworzą się związki o wysokich temperaturach topnienia.
Wiązanie Metaliczne
Wiązanie metaliczne występuje w metalach. Elektrony walencyjne tworzą "morze elektronowe" wokół kationów metali.
To tłumaczy przewodnictwo elektryczne i cieplne metali.
Elektroujemność
Elektroujemność to zdolność atomu do przyciągania elektronów w wiązaniu chemicznym. Im wyższa elektroujemność, tym silniej atom przyciąga elektrony.
Skala Paulinga służy do określania elektroujemności pierwiastków.
Równania Reakcji Chemicznych
Równanie reakcji chemicznej to zapis przebiegu reakcji. Pokazuje, jakie substancje reagują (substraty) i jakie powstają (produkty).
Zapis Równań
Substraty piszemy po lewej stronie równania. Produkty piszemy po prawej stronie równania. Używamy strzałki (→) aby pokazać kierunek reakcji.
Np.: A + B → C + D (A i B to substraty, C i D to produkty).
Bilansowanie Równań
Bilansowanie równań polega na dobraniu współczynników stechiometrycznych. Chodzi o to, aby liczba atomów każdego pierwiastka była taka sama po obu stronach równania.
Prawo zachowania masy: Masa substratów musi być równa masie produktów.
Przykładowo: H2 + O2 → H2O (Niezbilansowane)
Zbilansowane: 2 H2 + O2 → 2 H2O
Typy Reakcji Chemicznych
Istnieje wiele typów reakcji chemicznych. Warto je znać!
Reakcja Syntezy (łączenia)
Dwa lub więcej substratów łączą się w jeden produkt. Np.: N2 + 3 H2 → 2 NH3
Reakcja Analizy (rozkładu)
Jeden substrat rozkłada się na dwa lub więcej produktów. Np.: 2 H2O → 2 H2 + O2
Reakcja Wymiany
Atom lub grupa atomów w jednej cząsteczce jest zastępowana przez atom lub grupę atomów z innej cząsteczki.
Reakcja Pojedynczej Wymiany
Np.: Zn + 2 HCl → ZnCl2 + H2
Reakcja Podwójnej Wymiany
Np.: AgNO3 + NaCl → AgCl + NaNO3
Reakcje Redoks (utleniania-redukcji)
Reakcje redoks to reakcje, w których zmieniają się stopnie utlenienia atomów. Utlenianie to oddawanie elektronów, a redukcja to przyjmowanie elektronów.
Pamiętaj: utleniacz przyjmuje elektrony (ulega redukcji), a reduktor oddaje elektrony (ulega utlenianiu).
Stężenia Molowe
Stężenie molowe to liczba moli substancji rozpuszczonej w jednym litrze roztworu. Wyrażane w mol/dm3 (M).
n = C * V gdzie: n - liczba moli, C - stężenie molowe, V - objętość roztworu.
Sprawdzian - Przykładowe Pytania i Odpowiedzi
Oto kilka przykładowych pytań, które mogą pojawić się na sprawdzianie, wraz z odpowiedziami:
- Pytanie: Co to jest wiązanie kowalencyjne? Odpowiedź: To wiązanie, w którym atomy dzielą się elektronami.
- Pytanie: Jak zbilansować równanie: CH4 + O2 → CO2 + H2O? Odpowiedź: CH4 + 2 O2 → CO2 + 2 H2O
- Pytanie: Co to jest elektroujemność? Odpowiedź: To zdolność atomu do przyciągania elektronów w wiązaniu chemicznym.
- Pytanie: Podaj przykład reakcji syntezy. Odpowiedź: N2 + 3 H2 → 2 NH3
- Pytanie: Co to jest reakcja redoks? Odpowiedź: Reakcja, w której zmieniają się stopnie utlenienia atomów. Jedna substancja się utlenia (oddaje elektrony), a druga redukuje (przyjmuje elektrony).
Podsumowanie
Pamiętaj, że kluczem do sukcesu jest zrozumienie podstawowych pojęć: wiązania kowalencyjne, jonowe i metaliczne, elektroujemność, równania reakcji chemicznych, bilansowanie równań, typy reakcji (synteza, analiza, wymiana, redoks).
Staraj się rozwiązywać jak najwięcej zadań. Im więcej ćwiczysz, tym lepiej zrozumiesz materiał.
Powodzenia na sprawdzianie! Wierzę w Ciebie!