Cześć! Dzisiaj zajmiemy się kwasami. Brzmi strasznie? Spokojnie, rozłożymy to na czynniki pierwsze. Zrozumiesz, czym są kwasy, jak zapisywać ich wzory i jak wyglądają ich struktury.
Co to jest kwas?
Kwas to związek chemiczny. Posiada charakterystyczne właściwości. Najważniejszą cechą kwasu jest to, że w roztworze wodnym oddaje jony wodorowe (H+). Te jony sprawiają, że roztwór ma kwaśny smak (choć absolutnie nie próbuj kwasów w laboratorium bez pozwolenia!). Kwasy reagują z metalami, tworząc sole i uwalniając wodór.
Spotykamy je na co dzień. Ocet, który używamy w kuchni, zawiera kwas octowy. Sok z cytryny jest kwaśny dzięki obecności kwasu cytrynowego. Nasz żołądek produkuje kwas solny, który pomaga trawić jedzenie.
Wzór sumaryczny kwasu
Wzór sumaryczny kwasu to krótki zapis. Informuje nas, jakie pierwiastki wchodzą w skład cząsteczki kwasu i w jakiej proporcji. Zazwyczaj, wodór (H) piszemy na początku wzoru. Pozostałe pierwiastki podajemy w kolejności wynikającej z budowy cząsteczki.
Weźmy na przykład kwas solny. Używany jest w przemyśle i znajduje się w naszym żołądku. Jego wzór sumaryczny to HCl. Oznacza to, że jedna cząsteczka kwasu solnego składa się z jednego atomu wodoru (H) i jednego atomu chloru (Cl).
Innym przykładem jest kwas siarkowy(VI). Używany w akumulatorach samochodowych. Jego wzór sumaryczny to H2SO4. Oznacza to, że jedna cząsteczka kwasu siarkowego(VI) składa się z dwóch atomów wodoru (H), jednego atomu siarki (S) i czterech atomów tlenu (O).
Zauważ, że cyfry w indeksie dolnym (np. 2 w H2) oznaczają liczbę atomów danego pierwiastka w cząsteczce. Jeśli cyfry nie ma, oznacza to, że jest jeden atom danego pierwiastka.
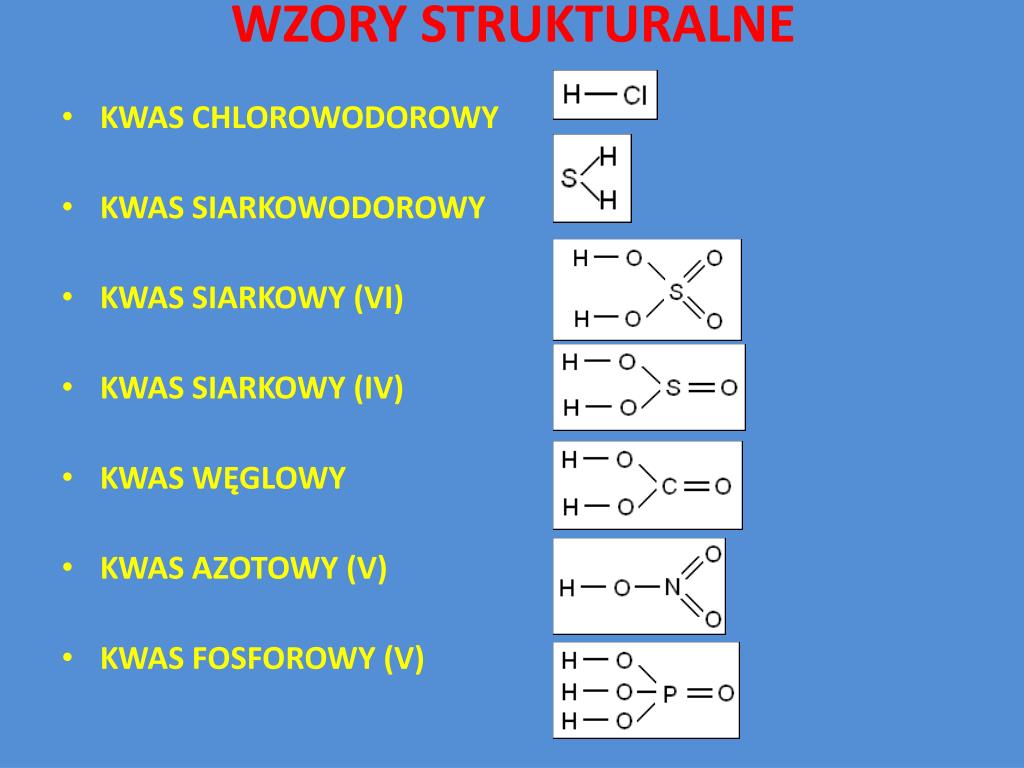
Wzór strukturalny kwasu
Wzór strukturalny pokazuje, jak atomy są połączone ze sobą w cząsteczce kwasu. Używamy linii, żeby zaznaczyć wiązania chemiczne. Każda linia reprezentuje parę elektronów, która łączy dwa atomy.
W przypadku kwasu solnego (HCl) wzór strukturalny jest prosty: H-Cl. To oznacza, że atom wodoru jest połączony pojedynczym wiązaniem z atomem chloru.
Kwas siarkowy(VI) (H2SO4) ma bardziej skomplikowany wzór strukturalny. Siarka jest atomem centralnym. Do siarki przyłączone są cztery atomy tlenu. Dwa z tych atomów tlenu są dodatkowo połączone z atomami wodoru. Wzór strukturalny wygląda następująco:
O
||
H-O-S-O-H
||
O
Wzory strukturalne są bardzo pomocne. Umożliwiają nam zobaczenie, jak wygląda cząsteczka w przestrzeni. Pozwalają zrozumieć właściwości chemiczne kwasu. Wzory strukturalne pomagają przewidywać, jak dany kwas będzie reagował z innymi związkami.
Kwasy tlenowe i beztlenowe
Kwasy dzielimy na dwie główne grupy: kwasy tlenowe i kwasy beztlenowe. Podział zależy od tego, czy w cząsteczce kwasu występuje tlen.
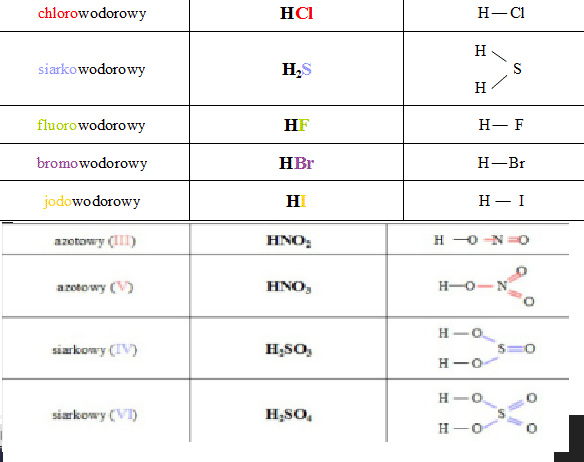
Kwasy beztlenowe to takie, które nie zawierają atomów tlenu. Przykładem jest wspomniany już kwas solny (HCl). Inne przykłady to kwas bromowodorowy (HBr) i kwas siarkowodorowy (H2S).
Kwasy tlenowe zawierają w swojej cząsteczce atomy tlenu. Kwas siarkowy(VI) (H2SO4) i kwas azotowy(V) (HNO3) to przykłady kwasów tlenowych. Kwas fosforowy(V) (H3PO4) również należy do tej grupy.
Dysocjacja kwasów
Gdy kwas rozpuszcza się w wodzie, rozpada się na jony. Ten proces nazywamy dysocjacją kwasową. Jony, które powstają, to jony wodorowe (H+) i aniony reszty kwasowej.
Na przykład, dysocjacja kwasu solnego (HCl) wygląda następująco: HCl → H+ + Cl-. Oznacza to, że cząsteczka kwasu solnego rozpada się na jon wodorowy (H+) i jon chlorkowy (Cl-).
Dysocjacja kwasu siarkowego(VI) (H2SO4) jest bardziej skomplikowana. Zachodzi etapami:
H2SO4 → H+ + HSO4-
HSO4- → H+ + SO42-
Oznacza to, że najpierw odłącza się jeden jon wodorowy, a następnie drugi. Anion HSO4- nazywamy wodorosiarczanem(VI), a anion SO42- to siarczan(VI).
Siła kwasu zależy od tego, jak dobrze dysocjuje w wodzie. Mocne kwasy dysocjują całkowicie. Oznacza to, że w roztworze praktycznie nie ma niezdysocjowanych cząsteczek kwasu. Słabe kwasy dysocjują tylko częściowo. W roztworze znajduje się mieszanina jonów i niezdysocjowanych cząsteczek kwasu.
Nazewnictwo kwasów
Nazwy kwasów tworzymy w określony sposób. Dla kwasów beztlenowych nazwa składa się z przedrostka "kwas" oraz nazwy niemetalu z końcówką "-owodorowy". Na przykład, HCl to kwas chlorowodorowy.
Dla kwasów tlenowych nazwa zależy od stopnia utlenienia pierwiastka centralnego. Jeśli pierwiastek centralny ma wyższy stopień utlenienia, nazwa kwasu kończy się na "-owy". Jeśli stopień utlenienia jest niższy, nazwa kwasu kończy się na "-awy". Na przykład, H2SO4 to kwas siarkowy(VI), a H2SO3 to kwas siarkawy(IV).
Warto zapamiętać kilka najważniejszych kwasów i ich nazwy. Ułatwi to zrozumienie dalszych zagadnień chemicznych. Mam nadzieję, że ten artykuł pomógł Ci zrozumieć, czym są kwasy. Poznałeś wzory sumaryczne i strukturalne kwasów. Powodzenia w dalszej nauce!