Witaj uczniu klasy 8! Przygotuj się na powtórkę z kwasów tlenowych i beztlenowych. Razem damy radę!
Kwasy – Wprowadzenie
Co to w ogóle są kwasy? To związki chemiczne. Mają specyficzne właściwości. Rozpuszczają się w wodzie. Tworzą jony wodorowe (H+).
Kwasy dzielimy na dwie główne grupy. Są to kwasy tlenowe i kwasy beztlenowe.
Kwasy Beztlenowe
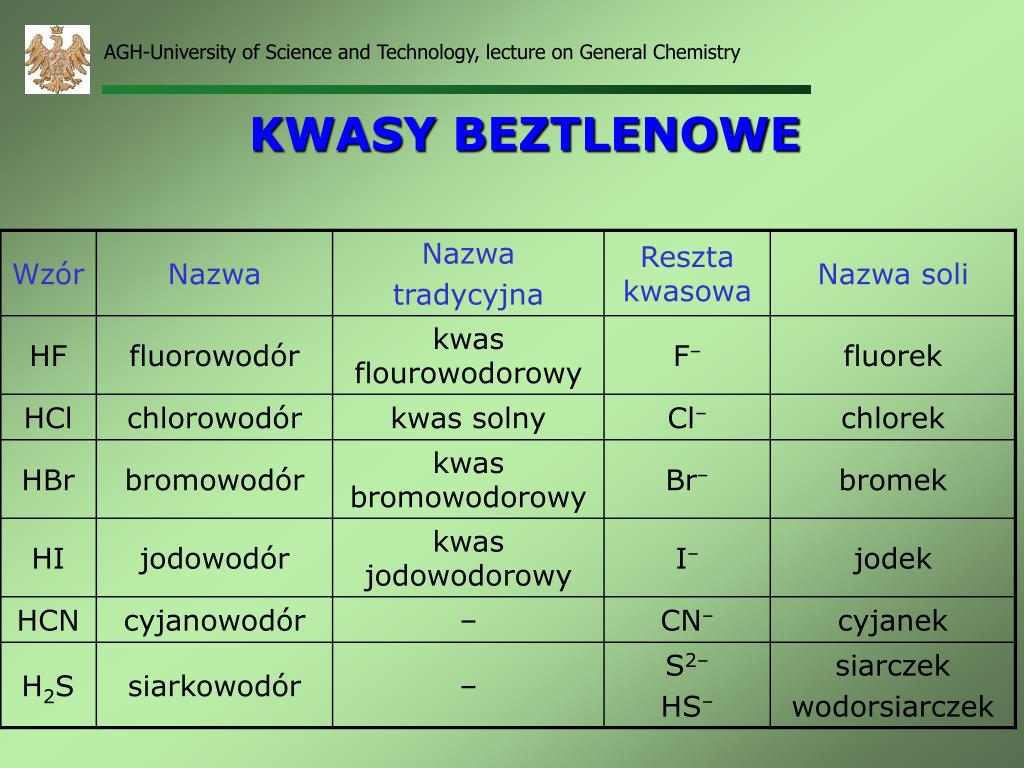
Kwasy beztlenowe są prostsze. Zawierają tylko dwa rodzaje atomów. Wodór i niemetal. Na przykład chlorowodór (HCl).
Wzór Ogólny
Wzór ogólny kwasu beztlenowego to HnX. Gdzie H to wodór, a X to niemetal. "n" oznacza wartościowość niemetalu.
Przykłady Kwasów Beztlenowych
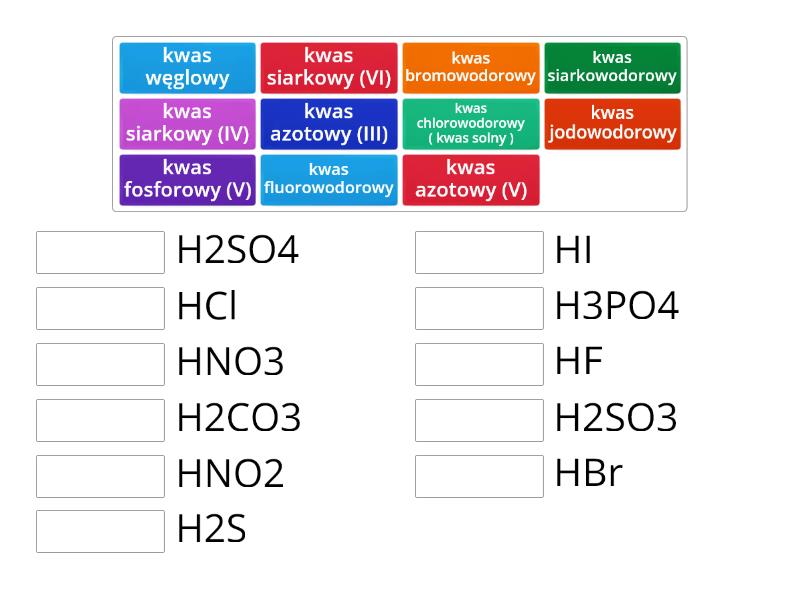
Najpopularniejsze kwasy beztlenowe to:
- Kwas chlorowodorowy (HCl), inaczej kwas solny.
- Kwas bromowodorowy (HBr).
- Kwas jodowodorowy (HI).
- Kwas siarkowodorowy (H2S).
Nazewnictwo Kwasów Beztlenowych
Nazwa kwasu beztlenowego składa się z dwóch członów. "Kwas" oraz nazwa niemetalu z końcówką "-owodorowy". Na przykład, kwas chlorowodorowy.
Właściwości Kwasów Beztlenowych
Kwasy beztlenowe mają charakterystyczne właściwości. Są żrące. Mają ostry zapach. Dobrze rozpuszczają się w wodzie. Tworzą roztwory o odczynie kwasowym.
W roztworach wodnych ulegają dysocjacji jonowej. To znaczy, że rozpadają się na jony. Na jony wodorowe (H+) i aniony reszty kwasowej (np. Cl-).
Kwasy Tlenowe
Kwasy tlenowe są bardziej złożone. Zawierają trzy rodzaje atomów. Wodór, tlen i niemetal.
Wzór Ogólny
Wzór ogólny kwasu tlenowego to HnXOm. Gdzie H to wodór, X to niemetal, a O to tlen. "n" i "m" oznaczają liczby atomów.
Przykłady Kwasów Tlenowych
Przykłady kwasów tlenowych to:
- Kwas siarkowy(VI) (H2SO4).
- Kwas azotowy(V) (HNO3).
- Kwas węglowy (H2CO3).
- Kwas fosforowy(V) (H3PO4).
Nazewnictwo Kwasów Tlenowych
Nazwa kwasu tlenowego jest bardziej skomplikowana. Zależy od wartościowości niemetalu. Używamy nazw takich jak: kwas siarkowy(VI), kwas azotowy(V).
Właściwości Kwasów Tlenowych
Kwasy tlenowe również mają charakterystyczne właściwości. Są żrące (niektóre bardzo). Dobrze rozpuszczają się w wodzie. Tworzą roztwory o odczynie kwasowym.
Podobnie jak kwasy beztlenowe, ulegają dysocjacji jonowej. Rozpadają się na jony. Na jony wodorowe (H+) i aniony reszty kwasowej (np. SO42-).
Dysocjacja Jonowa Kwasów
Dysocjacja jonowa to bardzo ważny proces. To rozpad kwasu na jony w roztworze wodnym. To właśnie jony wodorowe (H+) odpowiadają za kwasowy charakter roztworu.
Równanie dysocjacji pokazuje, jak dany kwas rozpada się na jony. Na przykład:
HCl → H+ + Cl-
H2SO4 → 2H+ + SO42-
Im więcej jonów wodorowych w roztworze, tym silniejszy jest kwas.
Reakcje Kwasów
Kwasy reagują z różnymi substancjami. Ważne reakcje to:
- Reakcja z metalami aktywnymi. Powstaje sól i wodór.
- Reakcja z tlenkami metali. Powstaje sól i woda.
- Reakcja z zasadami (neutralizacja). Powstaje sól i woda.
- Reakcja z węglanami. Powstaje sól, woda i dwutlenek węgla.
Zastosowanie Kwasów
Kwasy mają szerokie zastosowanie. W przemyśle, w laboratoriach, w życiu codziennym.
Przykłady:
- Kwas siarkowy(VI): produkcja nawozów, tworzyw sztucznych.
- Kwas azotowy(V): produkcja nawozów, materiałów wybuchowych.
- Kwas chlorowodorowy: produkcja chlorków, czyszczenie metali.
- Kwas octowy: ocet spożywczy, produkcja tworzyw sztucznych.
Wskaźniki
Wskaźniki to substancje. Zmieniają barwę w zależności od pH roztworu. Pomagają odróżnić kwasy od zasad.
Przykłady wskaźników:
- Lakmus: w kwasach czerwony, w zasadach niebieski.
- Fenoloftaleina: w kwasach bezbarwna, w zasadach malinowa.
- Oranż metylowy: w kwasach czerwony, w zasadach żółty.
Bezpieczeństwo Pracy z Kwasami
Praca z kwasami wymaga ostrożności. Są żrące. Mogą powodować oparzenia. Należy stosować środki ochrony osobistej. Okulary, rękawice, fartuch.
W razie kontaktu kwasu ze skórą, natychmiast przemyć dużą ilością wody.
Podsumowanie
Pamiętaj! Kwasy dzielimy na tlenowe i beztlenowe. Kwasy beztlenowe to wodór i niemetal. Kwasy tlenowe to wodór, tlen i niemetal. Dysocjacja jonowa to rozpad kwasu na jony. Kwasy reagują z metalami, tlenkami metali, zasadami i węglanami. Zachowaj ostrożność podczas pracy z kwasami!
Powodzenia na egzaminie! Wierzę w Ciebie!