Cześć! Porozmawiamy dzisiaj o kwasach. Ten temat jest często spotykany w chemii, szczególnie w drugiej klasie gimnazjum. Spróbujemy go rozłożyć na małe części, żeby wszystko było jasne. Będziemy używać przykładów z życia codziennego.
Czym są kwasy?
Kwasy to związki chemiczne. Mają specyficzne właściwości. Najważniejsza z nich to zdolność do oddawania jonów wodorowych (H+) w roztworach wodnych. To właśnie te jony wodorowe odpowiadają za kwasowy smak (ale nigdy nie próbuj kwasów w laboratorium!).
Można powiedzieć, że kwasy to substancje, które sprawiają, że coś jest kwaśne. Pamiętaj, że kwaśny smak to tylko jedna z cech kwasów. Nie wszystkie kwasy można bezpiecznie smakować! W rzeczywistości, wiele z nich jest bardzo niebezpiecznych.
W chemii definiujemy kwasy jako donory protonów. Proton to nic innego jak jon wodorowy (H+). Czyli, kwas oddaje proton innym związkom. Działa to trochę jak dawanie prezentu komuś innemu. W tym przypadku kwas oddaje proton.
Jak rozpoznać kwasy?
Kwasy mają kilka charakterystycznych cech. Po pierwsze, reagują z metalami. Często wydziela się wtedy wodór. Na przykład, kwas solny (HCl) reaguje z cynkiem (Zn), tworząc chlorek cynku (ZnCl2) i wodór (H2).
Kwasy zmieniają barwę wskaźników. Wskaźniki to substancje, które zmieniają kolor w zależności od pH roztworu. Lakmus staje się czerwony w obecności kwasów. Fenoloftaleina pozostaje bezbarwna.
Kwasy neutralizują zasady. Neutralizacja to reakcja, w której kwas reaguje z zasadą. Powstaje sól i woda. Na przykład, reakcja kwasu solnego (HCl) z wodorotlenkiem sodu (NaOH) daje chlorek sodu (NaCl), czyli sól kuchenną, i wodę (H2O).
Przykłady kwasów
Kwasy są wszędzie wokół nas. Wiele z nich znajduje się w jedzeniu. Kwas cytrynowy znajdziemy w cytrynach i innych owocach cytrusowych. Daje im charakterystyczny kwaśny smak.
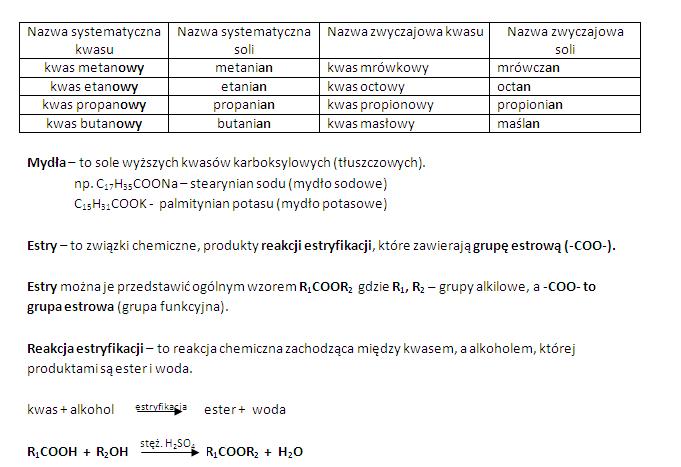
Kwas octowy to główny składnik octu. Używamy go do marynowania warzyw i jako przyprawę. To on sprawia, że marynowane ogórki mają kwaśny smak.
Kwas mlekowy powstaje w mięśniach podczas intensywnego wysiłku. Powoduje zakwasy. Znajdziemy go również w produktach mlecznych, takich jak jogurt.
Kwas solny (HCl) znajduje się w żołądku. Pomaga trawić pokarmy. Jest bardzo silnym kwasem.
Kwas siarkowy (H2SO4) jest używany w wielu gałęziach przemysłu. Stosuje się go m.in. do produkcji nawozów, detergentów i akumulatorów.
Podział kwasów
Kwasy dzielimy na różne sposoby. Najprostszy podział to na kwasy beztlenowe i kwasy tlenowe.
Kwasy beztlenowe nie zawierają atomów tlenu. Należą do nich np. kwas solny (HCl), kwas bromowodorowy (HBr), kwas fluorowodorowy (HF) i kwas siarkowodorowy (H2S).
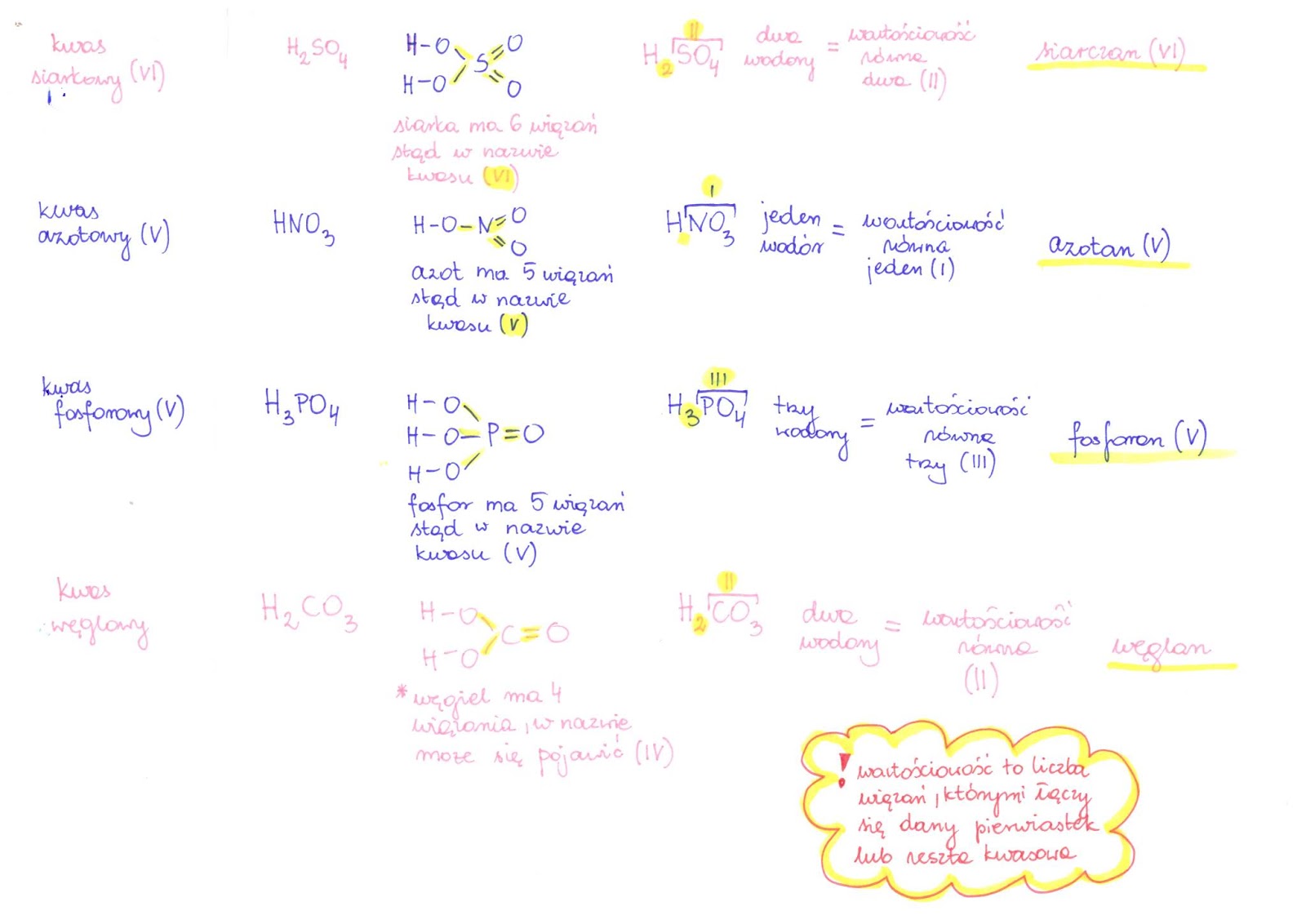
Kwasy tlenowe zawierają atomy tlenu. Należą do nich np. kwas siarkowy (H2SO4), kwas azotowy (HNO3), kwas fosforowy(V) (H3PO4) i kwas węglowy (H2CO3).
Kwasy możemy także podzielić na kwasy mocne i kwasy słabe. Moc kwasu zależy od tego, jak łatwo oddaje on jony wodorowe (H+) w roztworze wodnym. Mocne kwasy oddają te jony bardzo łatwo, a słabe - trudniej.
Do kwasów mocnych zaliczamy m.in. kwas solny (HCl), kwas siarkowy (H2SO4) i kwas azotowy (HNO3). Do kwasów słabych zaliczamy m.in. kwas octowy (CH3COOH), kwas węglowy (H2CO3) i kwas fosforowy(V) (H3PO4).
Właściwości kwasów
Kwasy mają wiele charakterystycznych właściwości. Już o niektórych wspominaliśmy. Warto je jeszcze raz powtórzyć i uporządkować.
Kwaśny smak. To jedna z najbardziej charakterystycznych cech kwasów. Pamiętaj jednak, że nie należy próbować kwasów w laboratorium. Wiele z nich jest żrących i niebezpiecznych.
Reakcja z metalami. Kwasy reagują z metalami. Wydziela się wodór. Im bardziej reaktywny metal, tym gwałtowniejsza reakcja.
Zmiana barwy wskaźników. Kwasy zmieniają barwę wskaźników. Lakmus staje się czerwony, fenoloftaleina pozostaje bezbarwna. Są to bardzo ważne cechy kwasów, które wykorzystujemy podczas badania kwasów.
Neutralizacja zasad. Kwasy reagują z zasadami w reakcji neutralizacji. Powstaje sól i woda. Reakcja neutralizacji jest reakcją egzotermiczną, co oznacza, że wydziela się ciepło.
Przewodzenie prądu elektrycznego. Roztwory kwasów przewodzą prąd elektryczny. Dzieje się tak, ponieważ w roztworze znajdują się jony (H+ i aniony kwasowe).
Bezpieczeństwo
Praca z kwasami wymaga zachowania ostrożności. Są to często substancje żrące. Mogą powodować poważne oparzenia. Zawsze należy nosić okulary ochronne i rękawice. Należy unikać wdychania oparów kwasów.
W razie kontaktu kwasu ze skórą, należy natychmiast przemyć to miejsce dużą ilością wody. Jeżeli kwas dostanie się do oczu, należy je przepłukiwać wodą przez co najmniej 15 minut i niezwłocznie skontaktować się z lekarzem.
Kwasy należy przechowywać w odpowiednich pojemnikach, z dala od substancji, z którymi mogą reagować. Należy również unikać mieszania różnych kwasów, ponieważ może to prowadzić do niebezpiecznych reakcji.
Zapamiętaj!
Kwasy to bardzo ważne związki chemiczne. Mają wiele zastosowań. Warto znać ich właściwości i zasady bezpiecznego postępowania z nimi. Pamiętaj, chemia może być fascynująca, ale zawsze trzeba dbać o bezpieczeństwo.