Witaj! Zaraz powtórzymy razem kwas siarkowy(VI). Przygotuj się! To ważny temat.
Podstawy kwasu siarkowego(VI)
Zacznijmy od początku. Czym jest kwas siarkowy(VI)?
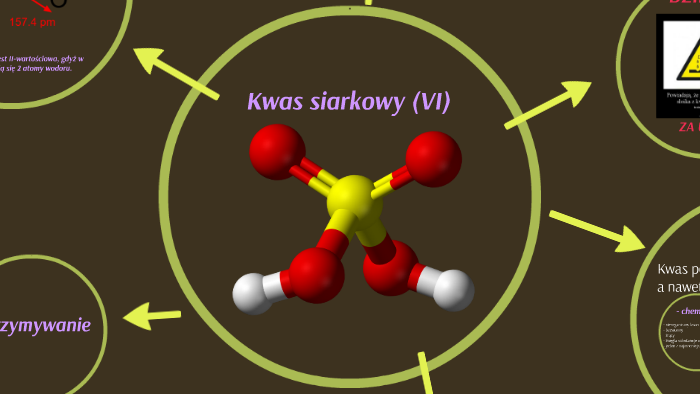
To inaczej H2SO4. To bardzo ważny związek chemiczny.
Wzór sumaryczny
H2SO4 – to jest wzór sumaryczny kwasu siarkowego(VI). Zapamiętaj go dobrze!
Co oznacza ten wzór? Już tłumaczę.
Mamy dwa atomy wodoru (H2), jeden atom siarki (S) i cztery atomy tlenu (O4). Proste, prawda?
Wzór sumaryczny informuje nas o liczbie i rodzaju atomów w cząsteczce. Nic więcej, nic mniej.
Właściwości fizyczne
Kwas siarkowy(VI) to oleista, bezbarwna ciecz. Jest cięższy od wody.
Rozpuszcza się w wodzie. Robi to bardzo dobrze! Podczas rozpuszczania wydziela się dużo ciepła.
Pamiętaj! Zawsze wlewaj kwas do wody, a nie na odwrót. To bardzo ważne dla bezpieczeństwa!
Stężony kwas siarkowy(VI) ma właściwości higroskopijne. Co to znaczy?
Oznacza to, że pochłania wodę z otoczenia. Dlatego kwas jest używany jako środek suszący.
Właściwości chemiczne
Kwas siarkowy(VI) jest bardzo silnym kwasem. Reaguje z wieloma substancjami.
Reaguje z metalami. Nie ze wszystkimi! Niektóre metale (np. złoto) są odporne na działanie kwasu.
Reaguje z zasadami. To typowa reakcja zobojętniania.
Reaguje z tlenkami metali. Powstają sole.
Kwas siarkowy(VI) ulega reakcjom charakterystycznym dla kwasów.
Dysocjacja jonowa
Kwas siarkowy(VI) dysocjuje w wodzie. Co to znaczy?
Oznacza to, że rozpada się na jony. Powstają jony wodorowe (H+) i jony siarczanowe(VI) (SO42-).
Dysocjacja przebiega dwuetapowo. Najpierw powstaje jon HSO4-.
Potem jon HSO4- dysocjuje na H+ i SO42-.
Obecność jonów wodorowych (H+) powoduje kwaśny odczyn roztworu.
Otrzymywanie kwasu siarkowego(VI)
Kwas siarkowy(VI) otrzymuje się przemysłowo. To proces wieloetapowy.
Najpierw otrzymuje się dwutlenek siarki (SO2). Spalanie siarki lub siarczków.
Następnie dwutlenek siarki utlenia się do trójtlenku siarki (SO3). Reakcja katalizowana tlenkami wanadu(V).
Potem trójtlenek siarki rozpuszcza się w kwasie siarkowym(VI). Powstaje oleum.
Na końcu oleum rozcieńcza się wodą. Otrzymuje się kwas siarkowy(VI) o odpowiednim stężeniu.
Zastosowanie kwasu siarkowego(VI)
Kwas siarkowy(VI) ma bardzo szerokie zastosowanie. Jest używany w wielu gałęziach przemysłu.
Używa się go do produkcji nawozów sztucznych. Superfosfaty, siarczan amonu.
Używa się go do produkcji detergentów. Środki czystości.
Używa się go do produkcji włókien sztucznych. Rayon.
Używa się go w przemyśle petrochemicznym. Rafinacja ropy naftowej.
Używa się go w akumulatorach ołowiowych. Elektrolit.
Używa się go w syntezie organicznej. Produkcja leków, barwników.
Kwas siarkowy(VI) jest jednym z najważniejszych związków chemicznych w przemyśle.
Podsumowanie
Pamiętaj o najważniejszych rzeczach:
- Wzór sumaryczny kwasu siarkowego(VI) to H2SO4.
- Kwas siarkowy(VI) to silny kwas o właściwościach higroskopijnych.
- Rozpuszczanie kwasu w wodzie jest procesem egzotermicznym (wydziela się ciepło).
- Kwas siarkowy(VI) ma bardzo szerokie zastosowanie w przemyśle.
Powodzenia na egzaminie! Wierzę w Ciebie!