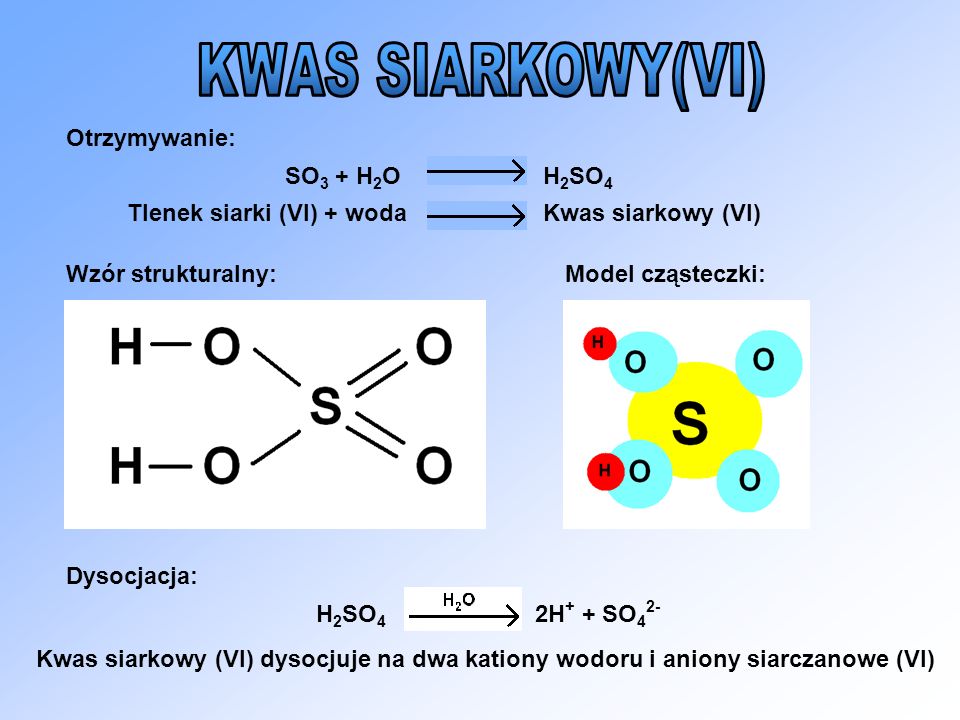
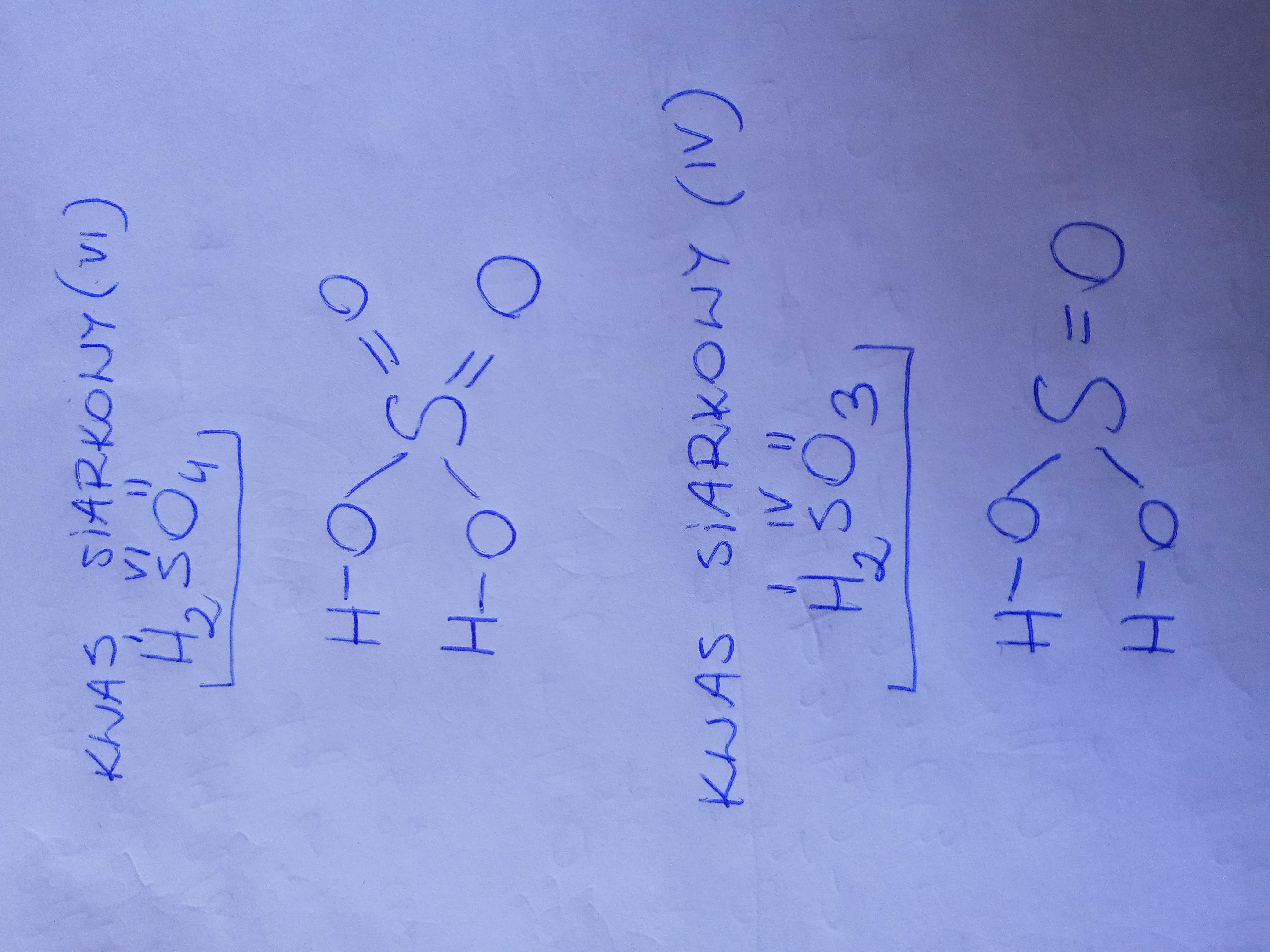
Kwas Siarkowy (VI), czyli H2SO4. Pamiętaj, to mocny kwas.
Co to w ogóle reszta kwasowa?
Wyobraź sobie kwas jako budowlę z klocków LEGO.
Kilka klocków to atomy wodoru (H).
Reszta klocków tworzy resztę kwasową.
Odkładamy atomy wodoru na bok. To, co zostało, to właśnie reszta kwasowa.
Dla kwasu siarkowego (VI) (H2SO4) odkładamy dwa atomy wodoru (2H).
Zostaje nam SO4.
To jest reszta kwasowa siarczanowa (VI), czyli SO42-.
Zauważ ładunek 2-. To dlatego, że oddaliśmy dwa atomy wodoru z ładunkiem +1 każdy.
Reszta Kwasowa Siarczanowa (VI) w akcji
Wyobraź sobie resztę kwasową jako ramię, które może się połączyć z czymś innym.
Może połączyć się z metalem.
Na przykład z sodem (Na).
Powstanie siarczan sodu (Na2SO4).
Dwa atomy sodu są potrzebne, aby zrównoważyć ładunek 2- reszty kwasowej.
Jak to zapamiętać?
Pomyśl o SO42- jako o magnesie z dwoma miejscami do przyłączenia się.
Każde miejsce potrzebuje czegoś z ładunkiem +1, np. jonu sodu (Na+).
Dwa Na+ pasują idealnie!
Kwas Siarkowy (VI) i jego reszta kwasowa w życiu codziennym
Kwas siarkowy (VI) jest używany w wielu miejscach.
Na przykład w akumulatorach samochodowych.
Jego reszta kwasowa, SO42-, występuje w wielu związkach chemicznych.
Siarczany, czyli sole kwasu siarkowego (VI), znajdują się w nawozach.
Pomagają roślinom rosnąć.
Są także w niektórych detergentach.
Przykłady związków z reszta kwasową siarczanową (VI):
- Siarczan magnezu (MgSO4) - sól Epsom, używana do kąpieli relaksacyjnych.
- Siarczan wapnia (CaSO4) - gips, używany w budownictwie.
- Siarczan miedzi (II) (CuSO4) - fungicyd, używany w rolnictwie.
Jak rozpoznać resztę kwasową w związku?
Szukaj grupy SO4 w nazwie i wzorze chemicznym.
Jeśli widzisz "siarczan" w nazwie, to na pewno tam jest!
Np. "siarczan potasu" to związek z reszta kwasową siarczanową (VI).
Podsumowanie
Reszta kwasowa siarczanowa (VI) to SO42-.
Powstaje po odłączeniu dwóch atomów wodoru od kwasu siarkowego (VI) (H2SO4).
Ma ładunek 2-.
Łączy się z innymi pierwiastkami i tworzy siarczany.
Siarczany są obecne w wielu produktach, których używamy codziennie.
Pamiętaj o magnesie z dwoma miejscami do przyłączenia, aby łatwiej zapamiętać SO42-!
To naprawdę nie jest takie trudne, prawda?
Teraz spróbuj rozwiązać kilka zadań. Powodzenia!
Zrozumienie reszty kwasowej to ważny krok w nauce chemii.
Będziesz mógł lepiej rozumieć reakcje chemiczne i budowę różnych związków.
Pamiętaj, że chemia to nie tylko wzory, ale też ciekawe zjawiska i praktyczne zastosowania!
I zawsze, gdy masz wątpliwości, wróć do przykładu z LEGO. Powinno pomóc!