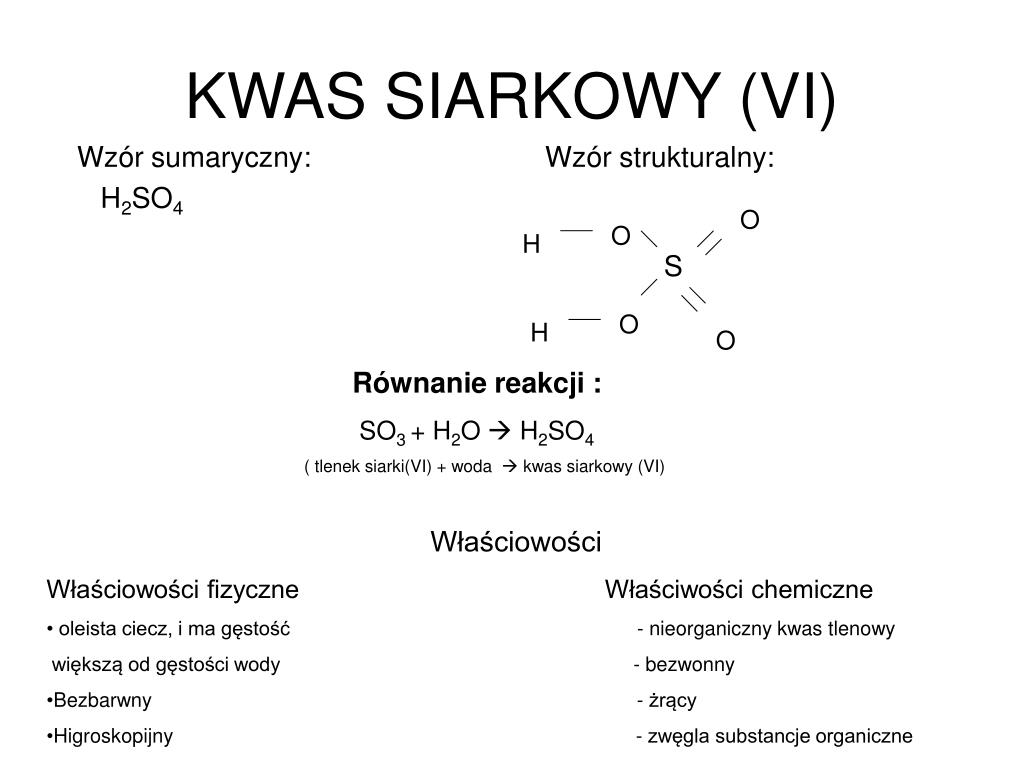
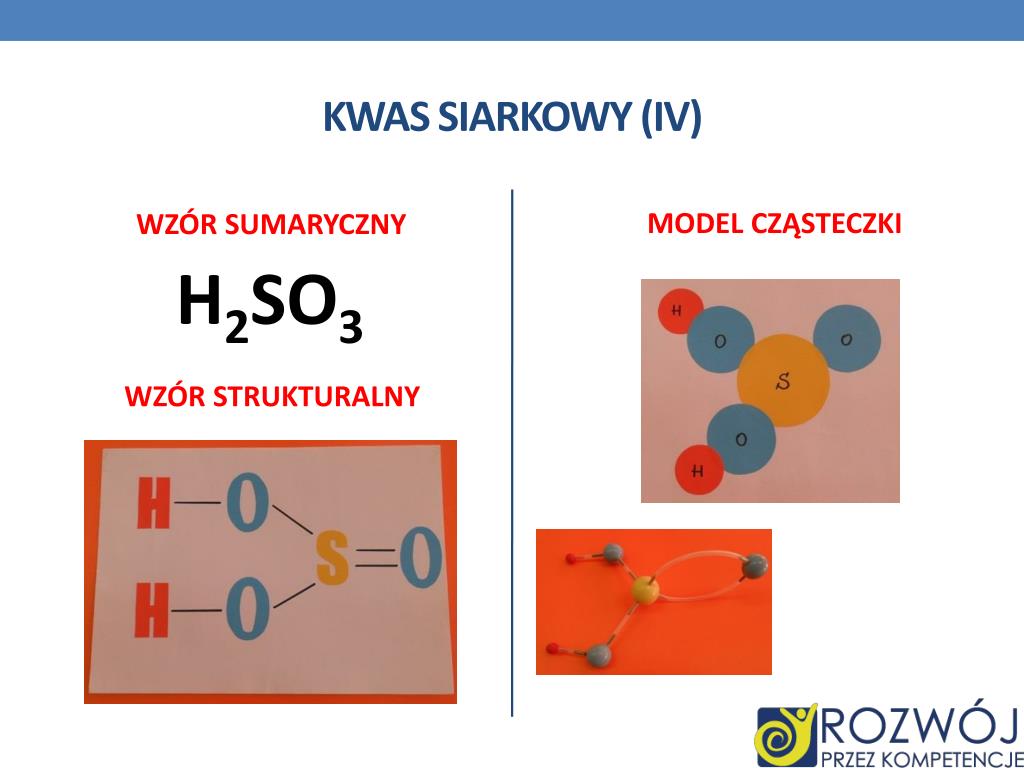
Witaj! Dziś zajmiemy się Kwasem Siarkowym(IV), czyli H2SO3. Gotowy na wizualną podróż?
Zaczniemy od wzoru strukturalnego. Wyobraź sobie scenę: S – siarka – siedzi w centrum. Do niej przyłączają się dwa OH – grupy hydroksylowe – jak ręce trzymające się ramienia.
Siarka ma jeszcze jedno "wolne ramię". Do niego przyłącza się atom O – tlen. To tworzy podwójne wiązanie. Wygląda to trochę jak bukiet kwiatów.
Czyli: H-O-S-O-H, a do tego || O. Widzisz to?
Rozkładamy wzór na czynniki pierwsze
H2SO3 to kwas beztlenowy. Czyli nie zawiera tlenu w nazwie, ale go posiada w strukturze. Pamiętaj o tym!
Zwróć uwagę na centralne położenie siarki. To ona jest najważniejszym elementem konstrukcyjnym tego związku. Wszystko kręci się wokół niej.
Dwie grupy hydroksylowe (-OH) to źródło kwaśnych właściwości. One łatwo oddają protony (H+).
Właściwości Kwasu Siarkowego(IV)
H2SO3 nie jest bardzo stabilny. To oznacza, że łatwo się rozkłada.
Wyobraź sobie budowlę z klocków LEGO, która łatwo się rozpada. Tak właśnie zachowuje się ten kwas.
Powstaje w wyniku rozpuszczania dwutlenku siarki (SO2) w wodzie. To reakcja odwracalna. To jak mieszanie cukru w wodzie – można go rozpuścić, ale i odparować wodę, odzyskując cukier.
Równanie reakcji: SO2 + H2O ⇌ H2SO3. Strzałki w obie strony oznaczają odwracalność.
To reduktor. To znaczy, że chętnie oddaje elektrony. Wyobraź sobie, że jest to osoba, która chętnie dzieli się swoimi zabawkami.
Ma właściwości wybielające. Działa podobnie jak chlor, ale jest mniej agresywny. Pomyśl o nim jak o delikatniejszej wersji wybielacza.
Zastosowania Kwasu Siarkowego(IV)
Używa się go w przemyśle spożywczym. Na przykład, do konserwacji owoców. Zapobiega ich brązowieniu. To jak dodanie soku z cytryny do jabłek, żeby nie ściemniały.
Stosowany jest też w przemyśle papierniczym. Wybiela papier. Nadaje mu ten jasny, biały kolor, który widzisz w zeszycie.
W laboratoriach chemicznych używa się go jako reduktora. Reaguje z różnymi substancjami, zmieniając ich właściwości.
Bezpieczeństwo to podstawa!
Pamiętaj, że praca z kwasami wymaga ostrożności! Używaj rękawic ochronnych i okularów. Unikaj kontaktu ze skórą i oczami.
H2SO3, choć mniej żrący niż kwas siarkowy (VI), wciąż może powodować podrażnienia. Traktuj go z szacunkiem!
W przypadku kontaktu ze skórą, natychmiast przemyj dużą ilością wody. W razie potrzeby skonsultuj się z lekarzem.
Podsumowanie
Kwas Siarkowy(IV) (H2SO3) to kwas beztlenowy o ciekawych właściwościach.
Powstaje w wyniku rozpuszczania dwutlenku siarki w wodzie.
Ma właściwości redukujące i wybielające.
Znajduje zastosowanie w przemyśle spożywczym i papierniczym.
Praca z nim wymaga zachowania środków ostrożności.
Mam nadzieję, że teraz łatwiej Ci zrozumieć ten związek chemiczny! Pamiętaj, wizualizacja to klucz do sukcesu!
Powodzenia w dalszej nauce chemii! Niech wzory będą Ci przyjazne!