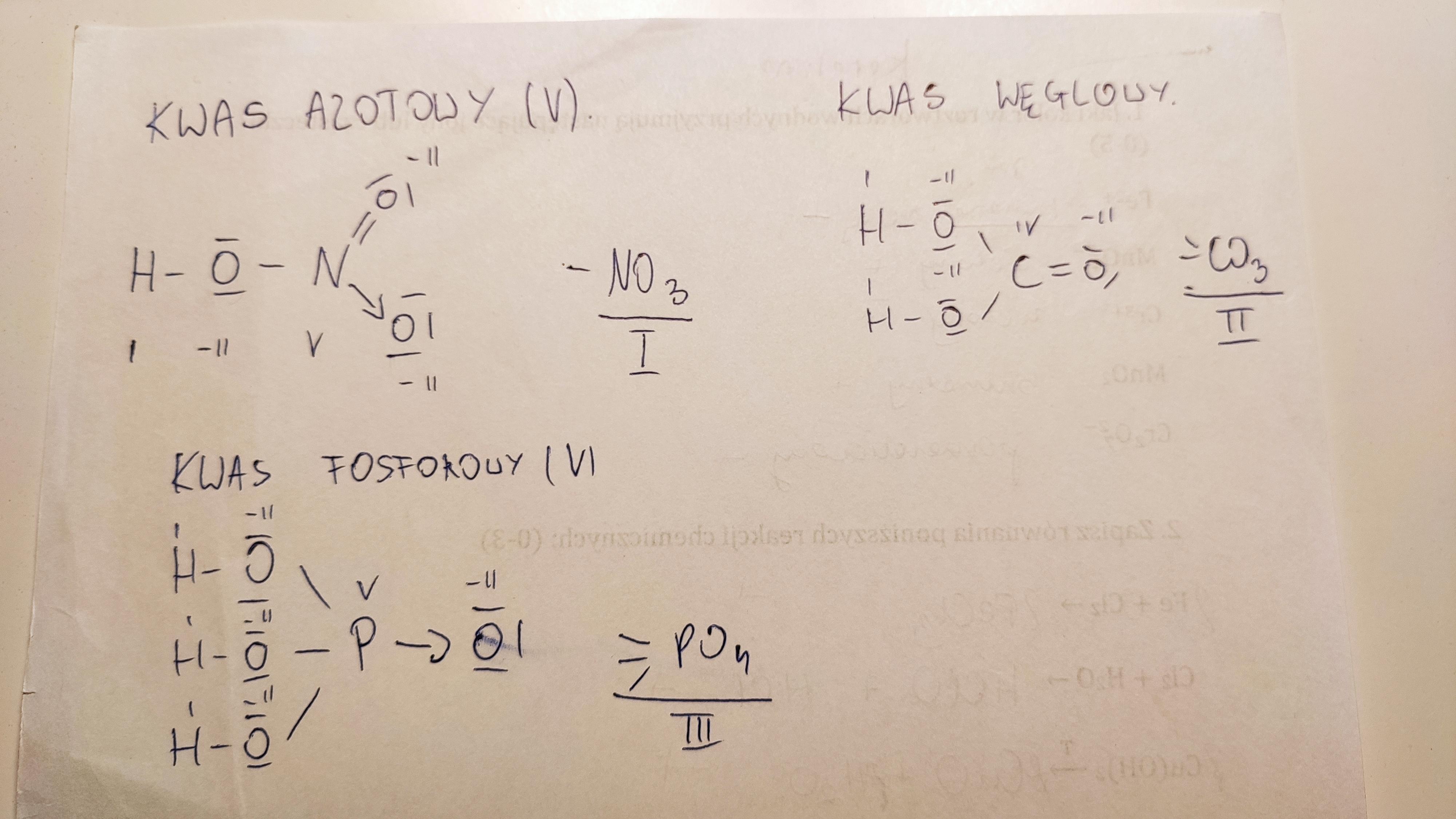Zajmiemy się teraz Kwasem Azotowym(V), jednym z ważniejszych związków chemicznych w przemyśle i laboratoriach. Omówimy jego wzór sumaryczny i właściwości. Zrozumienie tego zagadnienia jest kluczowe w chemii.
Co to jest Kwas Azotowy(V)?
Kwas Azotowy(V), znany również jako kwas azotowy, to silny kwas nieorganiczny. Jego nazwa systematyczna to kwas tetratlenoazotowy(V). Jest to ciecz bezbarwna lub lekko żółtawa. Posiada silne właściwości utleniające.
Wzór Sumaryczny Kwasu Azotowego(V)
Wzór sumaryczny Kwasu Azotowego(V) to HNO3. Ten wzór mówi nam, z jakich atomów i w jakiej ilości składa się jedna cząsteczka tego kwasu. Zwróćmy uwagę na poszczególne atomy.
HNO3 oznacza, że w jednej cząsteczce kwasu azotowego(V) znajduje się jeden atom wodoru (H), jeden atom azotu (N) i trzy atomy tlenu (O). Ta prosta formuła kryje za sobą złożoną chemię.
Budowa Cząsteczki Kwasu Azotowego(V)
Atom azotu (N) w cząsteczce HNO3 jest atomem centralnym. Wiąże się on z jedną grupą hydroksylową (-OH) oraz z dwoma atomami tlenu. Jeden z atomów tlenu łączy się z azotem wiązaniem podwójnym.
Taka budowa cząsteczki wpływa na właściwości Kwasu Azotowego(V). Wiązanie N=O jest stosunkowo silne, co przyczynia się do stabilności cząsteczki. Jednakże, łatwość odszczepienia protonu (H+) z grupy hydroksylowej czyni go silnym kwasem.
Właściwości Kwasu Azotowego(V)
Kwas Azotowy(V) jest substancją żrącą. Należy obchodzić się z nim ostrożnie. Może powodować poważne oparzenia skóry i oczu. Dlatego praca z nim wymaga odpowiednich środków ostrożności.
Jest silnym utleniaczem. Reaguje z wieloma metalami, niemetalami i związkami organicznymi. Utlenianie zachodzi gwałtownie i często z wydzieleniem ciepła. Reakcje te są wykorzystywane w wielu procesach przemysłowych.
HNO3 jest bardzo dobrze rozpuszczalny w wodzie. Tworzy z nią roztwory o różnym stężeniu. Stężony kwas azotowy(V) (około 68%) dymi na powietrzu. Jest to spowodowane uwalnianiem się tlenków azotu.
Otrzymywanie Kwasu Azotowego(V)
Kwas Azotowy(V) produkuje się przemysłowo na dużą skalę. Metoda produkcji opiera się na procesie Ostwalda. Proces ten obejmuje utlenianie amoniaku (NH3) do tlenku azotu(II) (NO), który następnie utlenia się do tlenku azotu(IV) (NO2).
Tlenek azotu(IV) reaguje z wodą. W wyniku tej reakcji powstaje Kwas Azotowy(V) i tlenek azotu(II), który jest zawracany do procesu. Proces jest efektywny i ekonomiczny.
Zastosowania Kwasu Azotowego(V)
Kwas Azotowy(V) ma szerokie zastosowanie w różnych gałęziach przemysłu. Jest używany do produkcji nawozów sztucznych, takich jak azotan amonu i azotan potasu. Nawozy te są niezbędne w rolnictwie.
Jest także stosowany w produkcji materiałów wybuchowych, takich jak trotyl (TNT) i nitrogliceryna. Te związki są wykorzystywane w górnictwie i wojskowości. Kontrolowane użycie materiałów wybuchowych jest kluczowe w wielu dziedzinach.
HNO3 znajduje zastosowanie w syntezie organicznej. Służy do nitrowania związków organicznych. Nitrowanie polega na wprowadzeniu grupy nitrowej (-NO2) do cząsteczki związku organicznego. Reakcja ta jest ważna w produkcji barwników, leków i innych związków organicznych.
Używany jest również do wytrawiania metali i czyszczenia powierzchni. Kwas azotowy(V) reaguje z metalami, tworząc sole azotanowe. Jest to wykorzystywane w procesach technologicznych.
Bezpieczeństwo Pracy z Kwasem Azotowym(V)
Praca z Kwasem Azotowym(V) wymaga zachowania szczególnej ostrożności. Należy nosić okulary ochronne i rękawice kwasoodporne. Unikać wdychania oparów kwasu.
W przypadku kontaktu kwasu ze skórą lub oczami, należy natychmiast przemyć je dużą ilością wody. Należy skonsultować się z lekarzem. Nie należy lekceważyć kontaktu z kwasem.
Przechowywać Kwas Azotowy(V) w szczelnie zamkniętych pojemnikach. Chronić przed dostępem światła i wysokiej temperatury. Należy przechowywać go w miejscu niedostępnym dla dzieci. Bezpieczne przechowywanie jest bardzo ważne.
Podsumowanie
Kwas Azotowy(V) (HNO3) to ważny związek chemiczny o szerokim zastosowaniu. Jest silnym kwasem i utleniaczem. Należy z nim pracować ostrożnie. Jego znajomość jest ważna w chemii i przemyśle.