Miareczkowanie mocnego kwasu mocną zasadą to fundamentalne zagadnienie w chemii analitycznej. Jest to idealny przykład do zrozumienia podstaw miareczkowania i krzywych miareczkowania. Uproszczony charakter reakcji pozwala na dokładne przewidywanie i analizę wyników.
Zrozumienie Reakcji i Krzywej
Reakcja zachodząca podczas miareczkowania mocnego kwasu mocną zasadą to reakcja neutralizacji. Jon wodorowy (H+) z kwasu reaguje z jonem wodorotlenkowym (OH-) z zasady, tworząc wodę (H2O). Reakcja ta przebiega w sposób ilościowy, co oznacza, że każdy jon H+ reaguje z jednym jonem OH-.
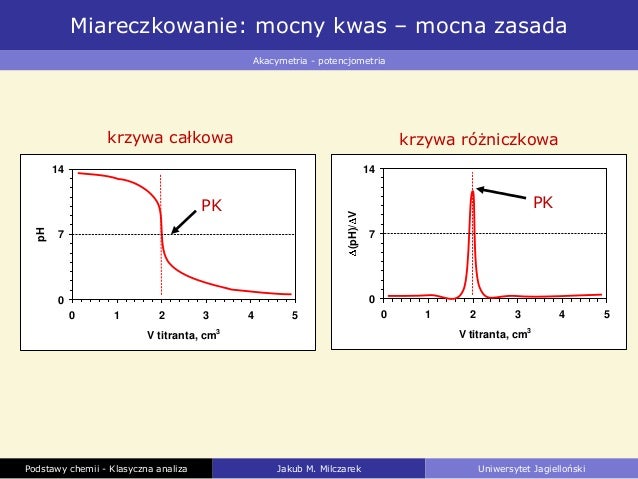
Krzywa miareczkowania przedstawia zależność pH roztworu od objętości dodanej zasady. Dla miareczkowania mocnego kwasu mocną zasadą krzywa ma charakterystyczny kształt litery "S". Na początku pH jest niskie, odpowiadające mocnemu kwasowi. W miarę dodawania zasady pH stopniowo wzrasta.
W punkcie równoważnikowym, czyli momencie, w którym ilość dodanej zasady jest stechiometrycznie równoważna ilości kwasu, pH roztworu wynosi 7. Dodanie nawet niewielkiej ilości zasady po punkcie równoważnikowym powoduje gwałtowny wzrost pH, ponieważ w roztworze zaczyna dominować nadmiar jonów OH-.
Jak Wyjaśnić to w Klasie
Rozpocznij od przypomnienia podstawowych definicji kwasów i zasad. Wyjaśnij koncepcję pH i jego skalę. Omów mocne kwasy i zasady, podkreślając, że ulegają one całkowitej dysocjacji w wodzie.
Użyj prostych przykładów, aby zilustrować reakcję neutralizacji. Możesz wykorzystać wizualizacje, takie jak animacje lub symulacje komputerowe, aby pokazać jak jony H+ i OH- reagują ze sobą tworząc wodę. Stwórz analogię, aby wyjaśnić ideę punktu równoważnikowego np. "wyobraź sobie równowagę pomiędzy dwiema osobami na wadze, gdzie kwas i zasada reprezentują wagę każdej osoby".
Podczas omawiania krzywej miareczkowania, zacznij od wytłumaczenia osi wykresu. Wyjaśnij, co reprezentuje każda oś (pH vs. objętość dodanej zasady). Następnie, krok po kroku, omów charakterystyczne punkty krzywej: początkowe pH, punkt równoważnikowy i końcowy fragment krzywej. Użyj rzeczywistych danych eksperymentalnych (jeśli to możliwe) lub symulowanych, aby uczniowie mogli zobaczyć, jak zmienia się pH w trakcie miareczkowania.
Typowe Błędy Uczniów
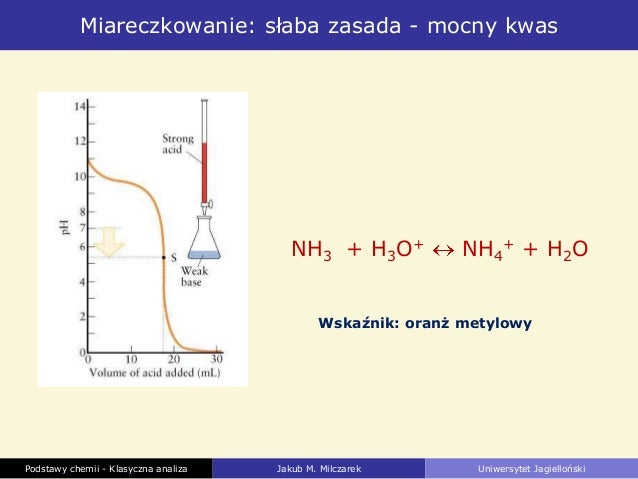
Jednym z częstych błędów jest mylenie punktu równoważnikowego z pH=7. Uczniowie muszą zrozumieć, że punkt równoważnikowy to punkt, w którym ilość kwasu jest równa ilości zasady. pH w punkcie równoważnikowym wynosi 7 tylko dla miareczkowania mocnego kwasu mocną zasadą. W przypadku słabych kwasów lub zasad pH w punkcie równoważnikowym może być różne od 7.
Innym błędem jest niezrozumienie, dlaczego pH gwałtownie zmienia się w pobliżu punktu równoważnikowego. Wyjaśnij, że w tym obszarze, nawet niewielka ilość dodanej zasady powoduje dużą zmianę w stężeniu jonów H+ lub OH-, co prowadzi do drastycznej zmiany pH.
Upewnij się, że uczniowie rozumieją różnicę między miareczkowaniem a neutralizacją. Neutralizacja to reakcja chemiczna, a miareczkowanie to technika analityczna wykorzystująca neutralizację do określenia stężenia substancji.
Jak Uatrakcyjnić Temat
Przeprowadź realne miareczkowanie w klasie. Wykorzystaj barwne wskaźniki pH, aby uczniowie mogli wizualnie obserwować zmiany zachodzące w trakcie miareczkowania. Zaangażuj uczniów w pomiary i obliczenia.
Zastosuj symulacje komputerowe lub wirtualne laboratoria. Pozwalają one uczniom na bezpieczne eksperymentowanie z różnymi kwasami i zasadami oraz obserwowanie krzywych miareczkowania. Oferują natychmiastową informację zwrotną, pomagając uczniom zrozumieć i korygować błędy.
Wykorzystaj codzienne przykłady, aby pokazać zastosowanie miareczkowania w życiu codziennym. Na przykład, miareczkowanie jest używane do określania kwasowości gleby w rolnictwie, do kontroli jakości żywności i napojów, oraz w przemyśle farmaceutycznym.
Zorganizuj konkurs, w którym uczniowie będą konkurować w dokładności miareczkowania próbki o nieznanym stężeniu. Zastosowanie gier i elementów rywalizacji motywuje uczniów do zaangażowania się w proces uczenia się.
Dodatkowe Wskazówki dla Nauczycieli
Podczas omawiania obliczeń związanych z miareczkowaniem, krok po kroku, wyjaśnij, jak wyznaczyć punkt równoważnikowy i jak wykorzystać go do obliczenia stężenia nieznanej próbki. Użyj wielu przykładów, aby uczniowie mogli przećwiczyć te obliczenia.
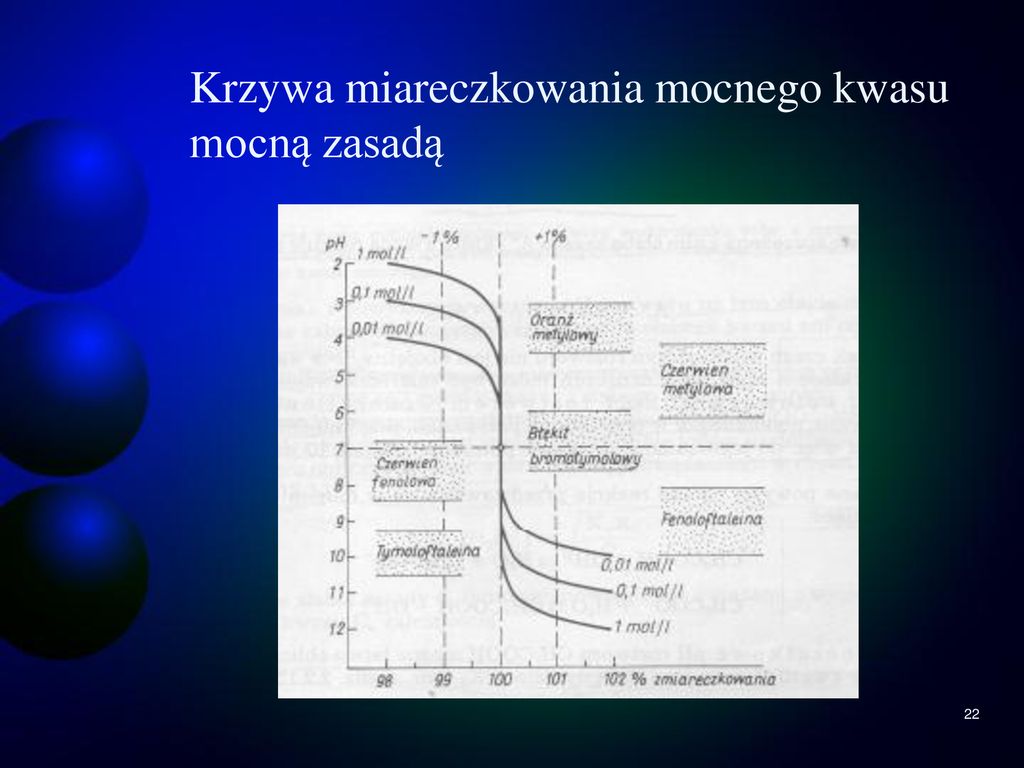
Zwróć uwagę na rolę wskaźników pH w miareczkowaniu. Wyjaśnij, jak dobrać wskaźnik, który zmienia kolor w pobliżu punktu równoważnikowego. Omów potencjalne źródła błędów związane z wyborem nieodpowiedniego wskaźnika.
Podkreśl znaczenie precyzji i dokładności podczas miareczkowania. Naucz uczniów, jak prawidłowo używać biurety, pipety i innych narzędzi laboratoryjnych. Wyjaśnij, jak minimalizować błędy pomiarowe.
Stwórz pozytywne środowisko uczenia się, w którym uczniowie czują się swobodnie zadając pytania i dzieląc się swoimi wątpliwościami. Zachęcaj do dyskusji i pracy zespołowej. Pozwól uczniom na wzajemne uczenie się od siebie.
Miareczkowanie mocnego kwasu mocną zasadą to świetny punkt wyjścia do dalszej eksploracji złożonych tematów w chemii analitycznej. Dobre zrozumienie podstaw pozwoli uczniom na łatwiejsze przyswajanie bardziej zaawansowanych zagadnień, takich jak miareczkowanie słabych kwasów i zasad, czy miareczkowanie redoks.