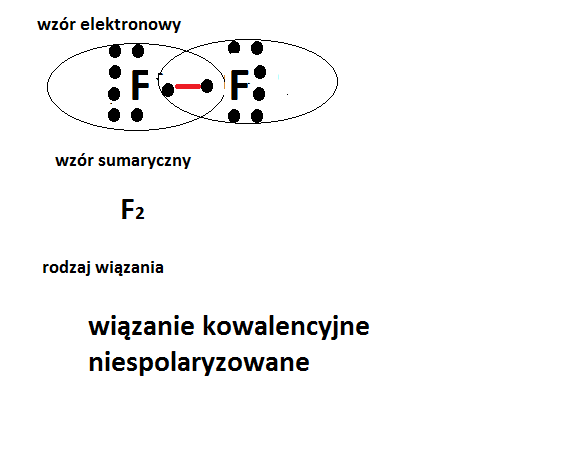Drodzy nauczyciele chemii, omawianie wiązań chemicznych, w tym wiązania kowalencyjnego niespolaryzowanego, jest fundamentalne dla zrozumienia właściwości materii. Niniejszy artykuł ma na celu ułatwienie Państwu efektywne przekazywanie tej wiedzy uczniom. Znajdziecie tu wskazówki, jak wyjaśnić ten typ wiązania, rozprawić się z powszechnymi błędami oraz zaangażować uczniów w proces uczenia się.
Czym jest wiązanie kowalencyjne niespolaryzowane?
Wiązanie kowalencyjne powstaje, gdy atomy dzielą się elektronami. Wiązanie kowalencyjne niespolaryzowane, zwane również wiązaniem atomowym, jest szczególnym przypadkiem, w którym elektrony są dzielone równomiernie między dwa atomy. Dzieje się tak, gdy atomy mają taką samą lub bardzo zbliżoną elektroujemność.
Elektroujemność to miara zdolności atomu do przyciągania elektronów w wiązaniu chemicznym. Jeśli różnica elektroujemności między dwoma atomami jest bardzo mała (zazwyczaj poniżej 0.4 w skali Paulinga), wiązanie uznaje się za niespolaryzowane. Powoduje to równomierny rozkład gęstości elektronowej.
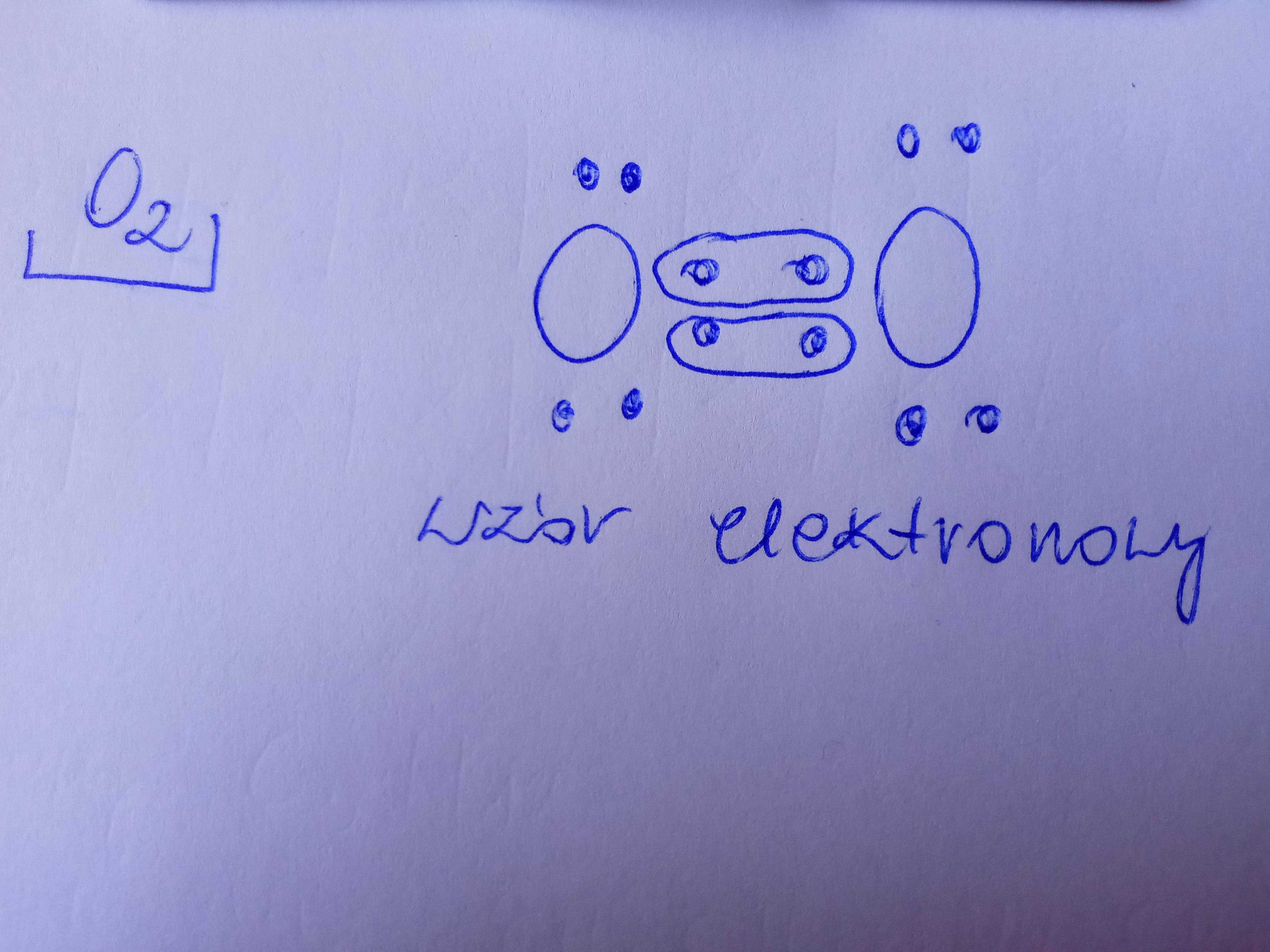
Klasycznym przykładem jest cząsteczka wodoru (H2). Oba atomy wodoru mają dokładnie taką samą elektroujemność. W konsekwencji, elektrony tworzące wiązanie są równie silnie przyciągane przez oba jądra, tworząc wiązanie kowalencyjne niespolaryzowane.
Jak wyjaśnić wiązanie kowalencyjne niespolaryzowane w klasie?
Zacznij od przypomnienia koncepcji elektroujemności. Wykorzystaj wizualizacje, takie jak skala Paulinga, aby pokazać, jak elektroujemność zmienia się w układzie okresowym pierwiastków. Użyj analogii, takich jak "przeciąganie liny", gdzie dwa identyczne atomy (o tej samej sile) przeciągają linę (elektrony) w równym stopniu. Model ten pomaga w zrozumieniu równego podziału elektronów.
Następnie wyjaśnij, że wiązanie kowalencyjne powstaje, gdy atomy dążą do uzyskania stabilnej konfiguracji elektronowej (oktetu lub dubletu dla wodoru). Dzielenie się elektronami jest sposobem na osiągnięcie tego celu. W przypadku wiązania niespolaryzowanego, żaden z atomów nie "ciągnie" elektronów bardziej niż drugi.
Wykorzystaj przykłady. Oprócz H2, omów inne cząsteczki dwuatomowe, takie jak Cl2, O2 i N2. Wyjaśnij, że w tych przypadkach również mamy do czynienia z wiązaniami kowalencyjnymi niespolaryzowanymi, ponieważ atomy są identyczne.
Dla bardziej zaawansowanych uczniów, możesz wprowadzić pojęcie momentu dipolowego. Wyjaśnij, że cząsteczki z wiązaniami kowalencyjnymi niespolaryzowanymi mają moment dipolowy równy zero, ponieważ rozkład ładunku jest symetryczny.
Powszechne błędne przekonania
Jednym z częstych błędów jest mylenie wiązania kowalencyjnego niespolaryzowanego z jonowym. Uczniowie mogą myśleć, że w każdym wiązaniu elektrony są całkowicie przekazywane lub całkowicie dzielone po równo. Wyjaśnij, że istnieje spektrum wiązań – od jonowych, przez spolaryzowane, aż po niespolaryzowane. Podkreśl, że charakter wiązania zależy od różnicy elektroujemności.
Innym błędem jest zakładanie, że wszystkie wiązania między identycznymi atomami są zawsze idealnie niespolaryzowane. Choć to prawda dla prostych cząsteczek dwuatomowych, w bardziej złożonych cząsteczkach, otoczenie atomu może wpływać na rozkład elektronów. Jest to jednak szczegół, który można pominąć na początkowym etapie nauki.
Uczniowie mogą również mieć trudności ze zrozumieniem pojęcia elektroujemności. Wyjaśnij, że to jest właściwość atomu, a nie całego pierwiastka w cząsteczce. Elektroujemność odnosi się do zdolności *pojedynczego* atomu do przyciągania elektronów w wiązaniu.
Jak zaangażować uczniów?
Wykorzystaj modelowanie. Można użyć kulek i patyczków, aby zbudować modele cząsteczek, pokazując równomierne rozmieszczenie elektronów wokół atomów w wiązaniach kowalencyjnych niespolaryzowanych. To pomaga wizualizować trójwymiarową strukturę cząsteczek.
Przeprowadź quizy i interaktywne ćwiczenia online. Istnieje wiele platform edukacyjnych, które oferują zadania na dopasowywanie, pytania wielokrotnego wyboru i gry, które sprawdzają zrozumienie pojęć związanych z wiązaniami chemicznymi. To zwiększa zaangażowanie i pozwala na natychmiastową informację zwrotną.
Zaproponuj uczniom zadania badawcze. Mogą poszukać informacji o właściwościach substancji, które zawierają głównie wiązania kowalencyjne niespolaryzowane, takich jak oleje i tłuszcze. Analiza tych właściwości w kontekście budowy molekularnej jest cennym ćwiczeniem.
Użyj analogii i porównań. Wykorzystaj codzienne sytuacje, aby zilustrować koncepcję równomiernego podziału. Na przykład, podział ciasta pomiędzy dwoje dzieci, które są równie silne i równie mocno chcą je zjeść.
Podkreśl znaczenie wiedzy o wiązaniach chemicznych dla zrozumienia właściwości materii. Wyjaśnij, jak rodzaj wiązania wpływa na temperaturę wrzenia, rozpuszczalność i inne cechy substancji. To pokazuje praktyczne zastosowanie wiedzy zdobytej na lekcjach chemii.
Podsumowanie
Nauczanie o wiązaniach kowalencyjnych niespolaryzowanych może być skuteczne, jeśli połączy się jasne wyjaśnienia z wizualizacjami, przykładami i interaktywnymi ćwiczeniami. Rozprawienie się z powszechnymi błędami i angażowanie uczniów w proces uczenia się jest kluczowe do zapewnienia trwałego zrozumienia tego ważnego pojęcia chemicznego. Pamiętajmy, że chemia jest fascynującą dziedziną i naszym zadaniem jest przekazywanie tej pasji uczniom.