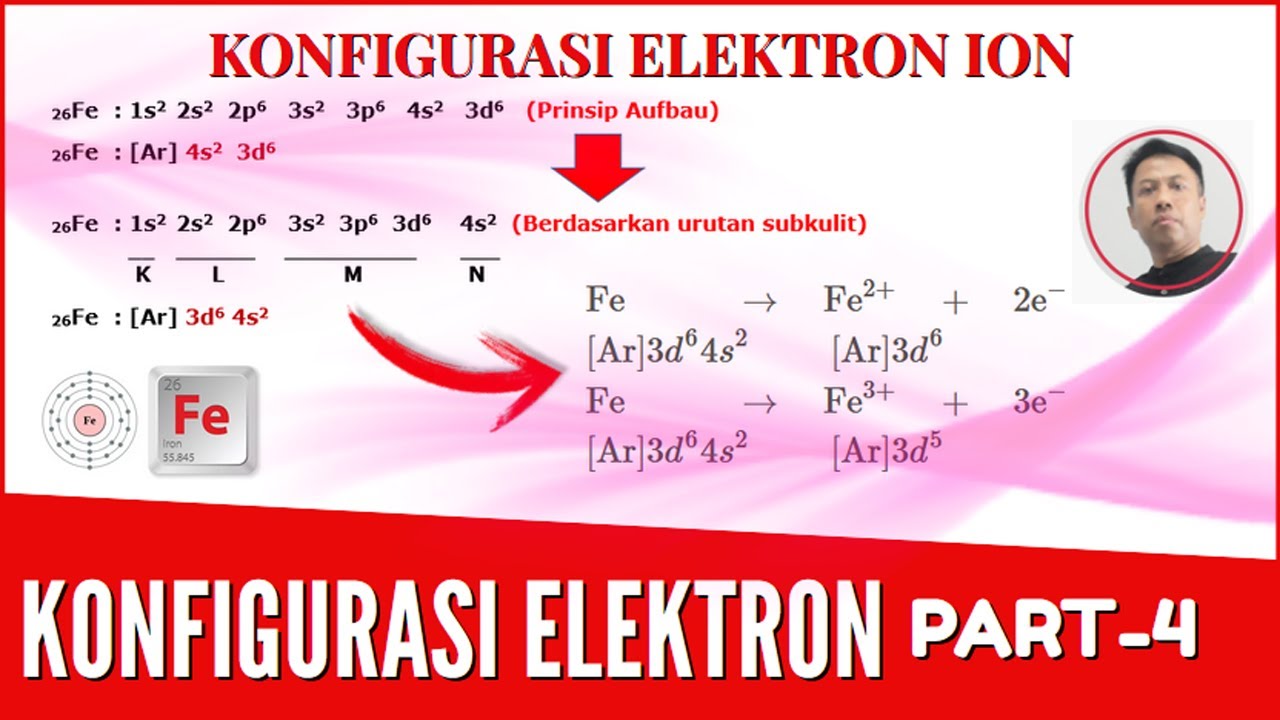
Cześć! Omówimy dzisiaj konfigurację elektronową kationów i anionów. Brzmi skomplikowanie? Bez obaw, rozłożymy to na czynniki pierwsze. Zrozumienie tego tematu jest kluczowe w chemii, ponieważ pomaga przewidzieć, jak atomy będą się łączyć i tworzyć związki. Potraktuj to jako rozszyfrowanie kodu, który rządzi światem molekuł!
Podstawy: Atom, Elektron, Konfiguracja Elektronowa
Zacznijmy od podstaw. Atom to najmniejsza jednostka pierwiastka chemicznego. Składa się z jądra (protony i neutrony) oraz krążących wokół niego elektronów. Wyobraź sobie atom jako małą planetę, gdzie jądro to Słońce, a elektrony to krążące planety. Elektrony mają ładunek ujemny.
Konfiguracja elektronowa to sposób rozmieszczenia elektronów w atomie. Elektrony "mieszkają" na różnych poziomach energetycznych, zwanych orbitalami i powłokami elektronowymi. Każda powłoka może pomieścić określoną liczbę elektronów. Zapis konfiguracji elektronowej pokazuje, ile elektronów znajduje się na każdej powłoce. Na przykład, konfiguracja elektronowa wodoru (H) to 1s1, co oznacza, że ma on jeden elektron na orbitalu 1s.
Pomyśl o konfiguracji elektronowej jak o adresie zamieszkania każdego elektronu w atomie. Mówi nam, gdzie możemy go znaleźć z największym prawdopodobieństwem. Znając adres, możemy przewidzieć, jak atom będzie się zachowywał!
Jony: Kationy i Aniony
Czas na najważniejsze pojęcia: jony. Jon to atom, który zyskał lub stracił elektrony. Jeśli atom traci elektrony, staje się jonem dodatnim, zwanym kationem. Jeśli atom zyskuje elektrony, staje się jonem ujemnym, zwanym anionem. Pamiętaj, że atomy są elektrycznie obojętne (mają równą liczbę protonów i elektronów).
Wyobraź sobie, że masz neutralną kostkę LEGO. Jeśli usuniesz z niej kilka klocków, będzie miała "niedobór" klocków, czyli będzie "dodatnia". Jeśli dodasz do niej kilka klocków, będzie miała "nadmiar" klocków, czyli będzie "ujemna". Kation to jak kostka LEGO, z której usunięto elektrony, a anion to jak kostka LEGO, do której dodano elektrony.
Dlaczego atomy tworzą jony? Chcą osiągnąć stabilną konfigurację elektronową, czyli taką, jaką mają gazy szlachetne (np. neon, argon). Gazy szlachetne mają pełną ostatnią powłokę elektronową, co czyni je bardzo stabilnymi i niereaktywnymi. Atomy oddają lub przyjmują elektrony, aby upodobnić się do gazów szlachetnych.
Konfiguracja Elektronowa Kationów
Kationy powstają, gdy atom traci elektrony. Elektrony są zawsze usuwane z najbardziej zewnętrznej powłoki, czyli z powłoki o najwyższym numerze. Aby napisać konfigurację elektronową kationu, najpierw piszemy konfigurację elektronową obojętnego atomu, a następnie usuwamy odpowiednią liczbę elektronów z najbardziej zewnętrznej powłoki.
Przykład: Sód (Na). Konfiguracja elektronowa sodu to 1s2 2s2 2p6 3s1. Sód traci jeden elektron, tworząc kation Na+. Ten elektron jest usuwany z powłoki 3s. Konfiguracja elektronowa Na+ to 1s2 2s2 2p6. Zauważ, że konfiguracja elektronowa Na+ jest taka sama jak konfiguracja elektronowa neonu (Ne), który jest gazem szlachetnym. Sód dąży do stabilności poprzez oddanie elektronu.
Inny przykład: Magnez (Mg). Konfiguracja elektronowa magnezu to 1s2 2s2 2p6 3s2. Magnez traci dwa elektrony, tworząc kation Mg2+. Elektrony są usuwane z powłoki 3s. Konfiguracja elektronowa Mg2+ to 1s2 2s2 2p6. Podobnie jak w przypadku sodu, konfiguracja elektronowa Mg2+ jest identyczna z konfiguracją elektronową neonu.
Konfiguracja Elektronowa Anionów
Aniony powstają, gdy atom zyskuje elektrony. Elektrony są dodawane do najbardziej zewnętrznej powłoki, aż do jej zapełnienia. Aby napisać konfigurację elektronową anionu, najpierw piszemy konfigurację elektronową obojętnego atomu, a następnie dodajemy odpowiednią liczbę elektronów do najbardziej zewnętrznej powłoki.
Przykład: Chlor (Cl). Konfiguracja elektronowa chloru to 1s2 2s2 2p6 3s2 3p5. Chlor zyskuje jeden elektron, tworząc anion Cl-. Ten elektron jest dodawany do powłoki 3p. Konfiguracja elektronowa Cl- to 1s2 2s2 2p6 3s2 3p6. Konfiguracja elektronowa Cl- jest taka sama jak konfiguracja elektronowa argonu (Ar), który jest gazem szlachetnym. Chlor dąży do stabilności poprzez przyjęcie elektronu.
Inny przykład: Tlen (O). Konfiguracja elektronowa tlenu to 1s2 2s2 2p4. Tlen zyskuje dwa elektrony, tworząc anion O2-. Elektrony są dodawane do powłoki 2p. Konfiguracja elektronowa O2- to 1s2 2s2 2p6. Podobnie jak w przypadku chloru, konfiguracja elektronowa O2- jest identyczna z konfiguracją elektronową neonu.
Podsumowanie i Przykłady z Życia Codziennego
Podsumowując: kationy powstają przez utratę elektronów (i mają ładunek dodatni), a aniony powstają przez zyskanie elektronów (i mają ładunek ujemny). Konfiguracja elektronowa jonu odzwierciedla zmianę w liczbie elektronów w atomie, a atomy dążą do osiągnięcia stabilnej konfiguracji elektronowej gazów szlachetnych.
Gdzie to widzimy w życiu codziennym? Na przykład, chlorek sodu (NaCl), czyli sól kuchenna, składa się z kationów sodu (Na+) i anionów chlorkowych (Cl-). Te jony utrzymują się razem dzięki siłom elektrostatycznym (przeciwne ładunki się przyciągają). Innym przykładem jest fluorek sodu (NaF), dodawany do past do zębów, aby zapobiegać próchnicy. Zawiera kationy sodu (Na+) i aniony fluorkowe (F-).
Zrozumienie konfiguracji elektronowej kationów i anionów pozwala nam lepiej rozumieć właściwości chemiczne związków, ich reaktywność i sposób, w jaki oddziałują ze sobą. To podstawowa wiedza, która otwiera drzwi do bardziej zaawansowanych koncepcji chemicznych. Gratulacje! Zrobiłeś duży krok w kierunku zrozumienia chemii na poziomie atomowym!