Zacznijmy od podstaw. Co to są alkohole? To związki organiczne. Charakteryzują się obecnością grupy hydroksylowej (-OH). Ta grupa jest przyłączona do atomu węgla. Ten atom węgla musi być w hybrydyzacji sp3.
Nazewnictwo alkoholi jest dość proste. Do nazwy macierzystego węglowodoru dodajemy końcówkę "-ol". Numerujemy łańcuch węglowy. Numerujemy tak, aby grupa -OH miała jak najniższy lokant. Na przykład, CH3OH to metanol. CH3CH2OH to etanol. CH3CH2CH2OH to propan-1-ol.
Podział alkoholi
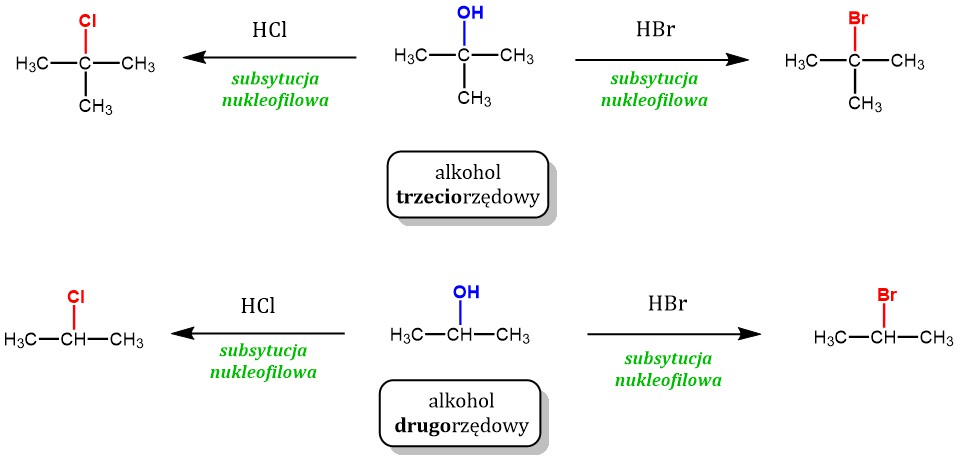
Alkohole dzielimy na kilka sposobów. Jednym z nich jest podział ze względu na rzędowość atomu węgla. Do którego przyłączona jest grupa -OH. Wyróżniamy alkohole pierwszorzędowe, drugorzędowe i trzeciorzędowe.
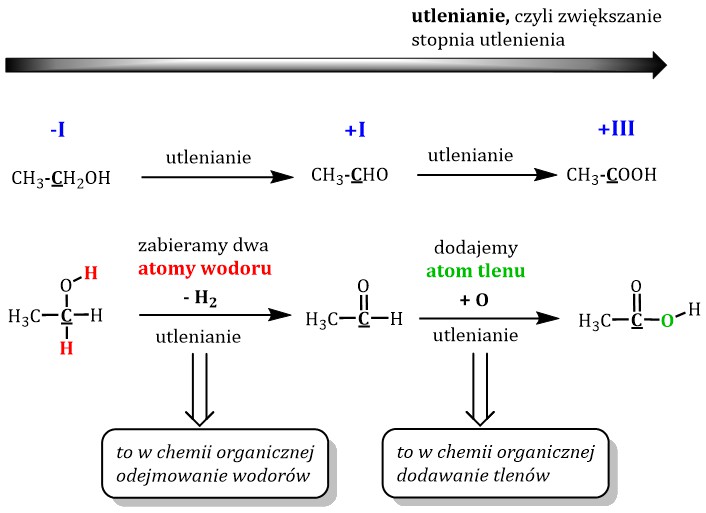
Alkohole pierwszorzędowe: Grupa -OH przyłączona jest do atomu węgla. Ten atom węgla łączy się z jednym innym atomem węgla. Przykładem jest etanol (CH3CH2OH). Utlenianie alkoholi pierwszorzędowych prowadzi do aldehydów. Dalsze utlenianie prowadzi do kwasów karboksylowych.
Alkohole drugorzędowe: Grupa -OH przyłączona jest do atomu węgla. Ten atom węgla łączy się z dwoma innymi atomami węgla. Przykładem jest propan-2-ol (CH3CH(OH)CH3). Utlenianie alkoholi drugorzędowych prowadzi do ketonów.
Alkohole trzeciorzędowe: Grupa -OH przyłączona jest do atomu węgla. Ten atom węgla łączy się z trzema innymi atomami węgla. Przykładem jest 2-metylo-propan-2-ol ((CH3)3COH). Alkohole trzeciorzędowe są trudne do utlenienia. Zazwyczaj wymaga to bardzo silnych utleniaczy i prowadzi do rozerwania wiązań C-C.
Właściwości alkoholi
Alkohole wykazują charakterystyczne właściwości fizyczne. Są one związane z obecnością grupy hydroksylowej. Grupa -OH tworzy wiązania wodorowe. Wpływa to na temperaturę wrzenia. Alkohole mają wyższe temperatury wrzenia niż odpowiadające im alkany.
Rozpuszczalność alkoholi w wodzie zależy od długości łańcucha węglowego. Krótkie alkohole (np. metanol, etanol) są dobrze rozpuszczalne w wodzie. Długie alkohole są mniej rozpuszczalne w wodzie. Wpływa na to hydrofobowy charakter łańcucha węglowego.
Alkohole reagują z metalami aktywnymi. Na przykład z sodem lub potasem. W wyniku reakcji powstają alkoholany i wodór. 2 CH3CH2OH + 2 Na → 2 CH3CH2ONa + H2. Alkoholany są silnymi zasadami.
Reakcje alkoholi
Alkohole ulegają wielu ważnym reakcjom chemicznym. Jedną z nich jest reakcja dehydratacji. Polega ona na eliminacji cząsteczki wody z alkoholu. W wyniku powstaje alken. Reakcja zachodzi w obecności katalizatora kwasowego (np. stężonego kwasu siarkowego) i wysokiej temperatury.
Alkohole ulegają reakcji estryfikacji. Jest to reakcja alkoholu z kwasem karboksylowym. W wyniku powstaje ester i woda. Reakcja jest odwracalna i zachodzi w obecności katalizatora kwasowego.
Reakcja alkoholi z halogenowodorami (np. HCl, HBr) prowadzi do powstania halogenków alkilu. Reakcja zachodzi w obecności katalizatora (np. ZnCl2). Rzędowość alkoholu ma wpływ na mechanizm reakcji.
Przykłady i zastosowania
Metanol (CH3OH) jest używany jako rozpuszczalnik. Stosowany jest także w produkcji formaldehydu. Jest silnie toksyczny. Spożycie nawet niewielkiej ilości może spowodować ślepotę lub śmierć.
Etanol (CH3CH2OH) jest składnikiem napojów alkoholowych. Używany jest jako rozpuszczalnik. Stosowany jest także jako środek dezynfekujący. Jest produkowany przez fermentację cukrów lub hydratację etenu.
Glicerol (propan-1,2,3-triol) jest trihydroksyalkoholem. Jest stosowany w kosmetyce. Używany jest także w farmacji. Dodatkowo wykorzystywany jest w produkcji materiałów wybuchowych (np. nitrogliceryny).
Podsumowanie
Alkohole to ważna grupa związków organicznych. Charakteryzują się obecnością grupy hydroksylowej. Występują w różnych zastosowaniach. Znajdują się w przemyśle, medycynie i życiu codziennym. Zrozumienie ich właściwości i reakcji jest kluczowe. Jest to ważne w chemii organicznej.
Pamiętaj, aby dokładnie powtórzyć nazewnictwo. Zwróć uwagę na reakcje charakterystyczne dla alkoholi. Powodzenia na kartkówce!