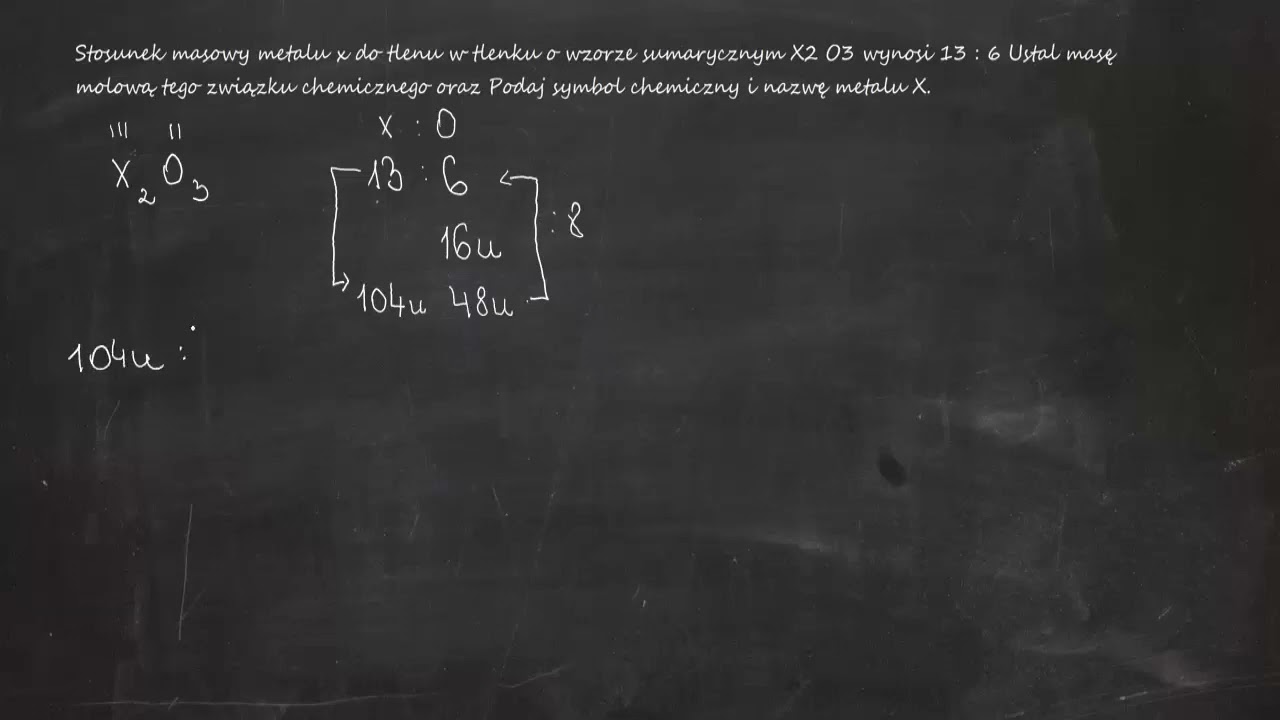Hej! Przygotowujesz się do egzaminu z chemii? Świetnie! Dzisiaj skupimy się na zadaniach związanych z masą cząsteczkową tlenków.
Wprowadzenie do Tlenków
Czym są tlenki? To związki chemiczne, które zawierają tlen połączony z innym pierwiastkiem. Pamiętaj o tym!
Wzór ogólny tlenku to ExOy, gdzie E to symbol pierwiastka, a x i y to indeksy stechiometryczne.
Na przykład: CO2 (dwutlenek węgla), Na2O (tlenek sodu).
Masa Cząsteczkowa – Podstawa Obliczeń
Masa cząsteczkowa (M) to suma mas atomowych wszystkich atomów w cząsteczce. Wyrażamy ją w jednostkach masy atomowej (u) lub g/mol.
Aby obliczyć masę cząsteczkową, potrzebujesz układu okresowego pierwiastków. Tam znajdziesz masy atomowe każdego pierwiastka.
Pamiętaj! Zaokrąglaj masy atomowe do liczb całkowitych lub jednego miejsca po przecinku, w zależności od wymagań zadania.
Obliczanie Masy Cząsteczkowej Tlenku – Krok po Kroku
Przyjrzyjmy się, jak to zrobić na przykładach. Będzie łatwiej!
Przykład 1: Dwutlenek Węgla (CO2)
Krok 1: Zidentyfikuj pierwiastki i ich liczbę w cząsteczce. Mamy jeden atom węgla (C) i dwa atomy tlenu (O).
Krok 2: Znajdź masy atomowe w układzie okresowym. MC = 12 u, MO = 16 u.
Krok 3: Oblicz masę cząsteczkową. MCO2 = (1 × MC) + (2 × MO) = (1 × 12 u) + (2 × 16 u) = 12 u + 32 u = 44 u.
Masa cząsteczkowa CO2 wynosi 44 u.
Przykład 2: Tlenek Sodu (Na2O)
Krok 1: Zidentyfikuj pierwiastki i ich liczbę. Mamy dwa atomy sodu (Na) i jeden atom tlenu (O).
Krok 2: Znajdź masy atomowe. MNa = 23 u, MO = 16 u.
Krok 3: Oblicz masę cząsteczkową. MNa2O = (2 × MNa) + (1 × MO) = (2 × 23 u) + (1 × 16 u) = 46 u + 16 u = 62 u.
Masa cząsteczkowa Na2O wynosi 62 u.
Przykład 3: Trójtlenek Diazotu (N2O3)
Krok 1: Zidentyfikuj pierwiastki i ich liczbę: Dwa atomy azotu (N) i trzy atomy tlenu (O).
Krok 2: Znajdź masy atomowe: MN = 14 u, MO = 16 u.
Krok 3: Oblicz masę cząsteczkową: MN2O3 = (2 × MN) + (3 × MO) = (2 × 14 u) + (3 × 16 u) = 28 u + 48 u = 76 u.
Masa cząsteczkowa N2O3 wynosi 76 u.
Zadania z Treścią – Utrwal Swoją Wiedzę
Często spotkasz zadania, w których trzeba wykorzystać masę cząsteczkową do dalszych obliczeń. Na przykład:
Zadanie: Oblicz zawartość procentową tlenu w tlenku magnezu (MgO).
Krok 1: Oblicz masę cząsteczkową MgO. MMg = 24 u, MO = 16 u. MMgO = 24 u + 16 u = 40 u.
Krok 2: Oblicz masę tlenu w cząsteczce MgO. Mamy jeden atom tlenu, więc jego masa to 16 u.
Krok 3: Oblicz zawartość procentową tlenu. (%O = (MO / MMgO) × 100% = (16 u / 40 u) × 100% = 40%.
Zawartość procentowa tlenu w tlenku magnezu wynosi 40%.
Typowe Pułapki i Jak Ich Unikać
Bądź ostrożny z indeksami stechiometrycznymi! Nie zapomnij pomnożyć masy atomowej pierwiastka przez odpowiedni indeks.
Upewnij się, że używasz poprawnej masy atomowej z układu okresowego. Różne źródła mogą podawać nieco inne wartości, ale zazwyczaj różnice są niewielkie.
Zawsze sprawdzaj jednostki! Masa cząsteczkowa wyrażana jest w jednostkach masy atomowej (u) lub g/mol.
Podsumowanie – Kluczowe Punkty
Tlenki to związki tlenu z innymi pierwiastkami.
Masa cząsteczkowa to suma mas atomowych wszystkich atomów w cząsteczce.
Użyj układu okresowego do znalezienia mas atomowych pierwiastków.
Pamiętaj o indeksach stechiometrycznych!
Zawartość procentową pierwiastka obliczamy dzieląc masę tego pierwiastka w cząsteczce przez masę całej cząsteczki i mnożąc przez 100%.
Powodzenia na egzaminie! Pamiętaj, że praktyka czyni mistrza. Im więcej zadań rozwiążesz, tym lepiej zrozumiesz temat.
Jesteś na dobrej drodze! Dasz radę!