Hej! Przygotowujesz się do egzaminu z chemii? Świetnie! Zrozumienie różnicy między wodorotlenkiem a zasadą jest kluczowe. Pomogę Ci to ogarnąć!
Wodorotlenki: Co to takiego?
Wodorotlenki to związki chemiczne. Zawierają grupę hydroksylową (OH⁻).
Mają budowę jonową. Składają się z kationu metalu i anionu wodorotlenkowego.
Na przykład: wodorotlenek sodu (NaOH) albo wodorotlenek potasu (KOH).
Jak powstają wodorotlenki?
Wodorotlenki metali alkalicznych (grupa 1) i metali ziem alkalicznych (grupa 2, z wyjątkiem berylu i magnezu) powstają w wyniku reakcji metalu z wodą.
Na przykład: 2Na + 2H₂O → 2NaOH + H₂
Inne wodorotlenki można uzyskać poprzez reakcję soli z wodorotlenkiem mocnej zasady.
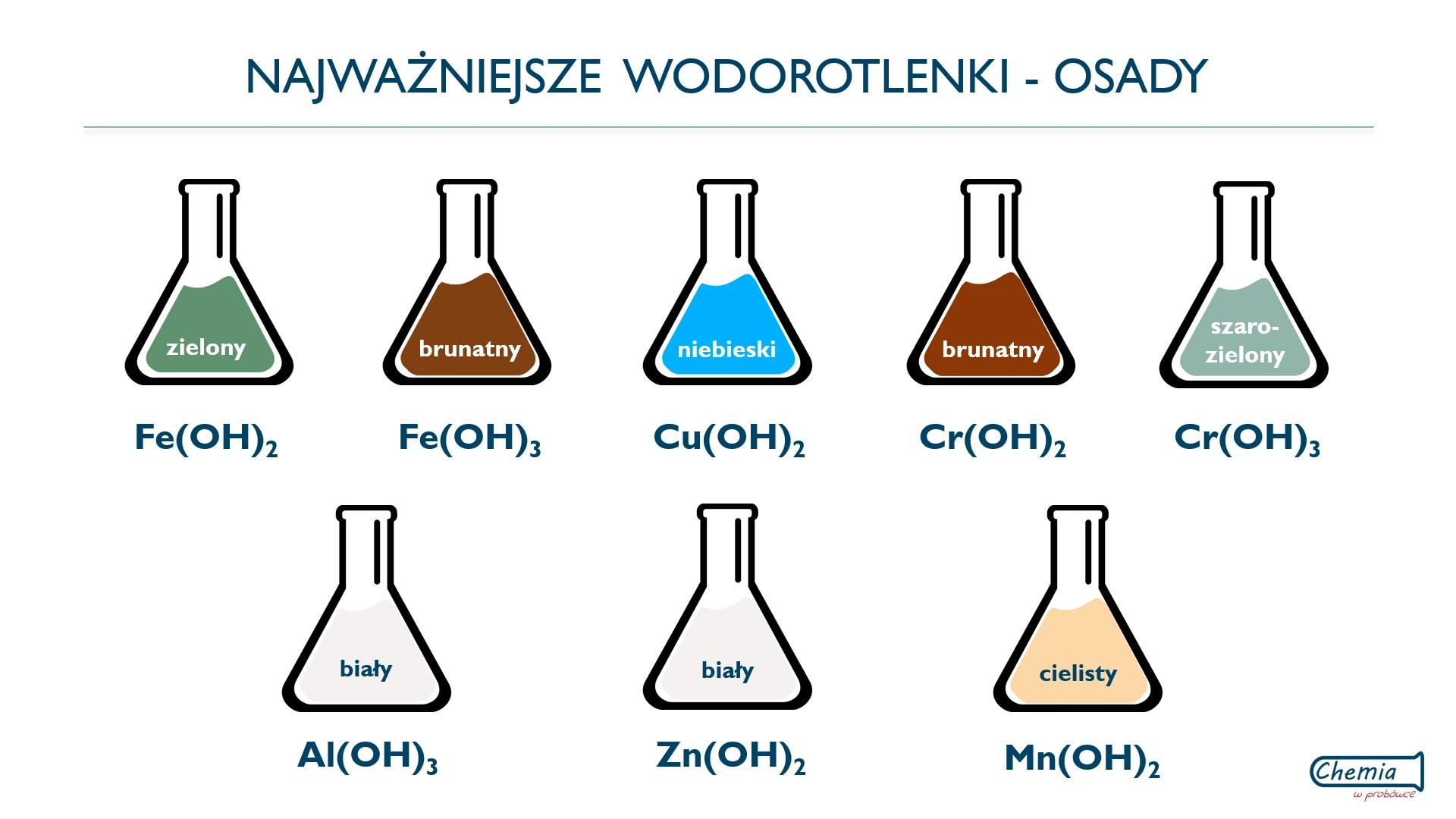
Na przykład: CuCl₂ + 2NaOH → Cu(OH)₂↓ + 2NaCl
Właściwości wodorotlenków
Wodorotlenki mogą być stałe (np. NaOH) lub mało rozpuszczalne w wodzie (np. Cu(OH)₂).
Wodorotlenki metali alkalicznych są silnie żrące. Należy z nimi ostrożnie pracować!
Roztwory wodorotlenków mają odczyn zasadowy. Zmieniają barwę wskaźników.
Zasady: Szersze pojęcie
Zasada to pojęcie szersze niż wodorotlenek. Odnosi się do substancji, które w roztworze wodnym zwiększają stężenie jonów hydroksylowych (OH⁻).
Zasady są akceptorami protonów (H⁺) według teorii Brønsteda-Lowry'ego.
Zasady to donory par elektronowych według teorii Lewisa.
Przykłady zasad
Wszystkie wodorotlenki metali alkalicznych i ziem alkalicznych są zasadami.
Ale nie tylko! Amoniak (NH₃) jest zasadą, chociaż nie jest wodorotlenkiem.
Aminy (pochodne amoniaku) też są zasadami.
Właściwości zasad
Zasady mają gorzki smak. (Nigdy nie próbuj! Są żrące!).
Są śliskie w dotyku (np. mydło, które powstaje w wyniku reakcji tłuszczu z zasadą).
Zasady reagują z kwasami, tworząc sole i wodę (reakcja zobojętniania).
Roztwory zasad przewodzą prąd elektryczny. Są elektrolitami.
Kluczowa Różnica: Wodorotlenek a Zasada
Wszystkie wodorotlenki metali alkalicznych i ziem alkalicznych są zasadami.
Ale nie wszystkie zasady są wodorotlenkami.
Wodorotlenki to konkretne związki chemiczne. Zawierają grupę OH⁻.
Zasada to szersze pojęcie. Obejmuje substancje, które zwiększają stężenie jonów OH⁻ w roztworze. Albo akceptują protony, lub donują pary elektronowe.
Pomyśl o tym tak: każdy kwadrat jest prostokątem, ale nie każdy prostokąt jest kwadratem. Podobnie, każdy wodorotlenek (metalu alkalicznego lub ziem alkalicznego) jest zasadą, ale nie każda zasada jest wodorotlenkiem.
Przykład dla lepszego zrozumienia
Wodorotlenek sodu (NaOH) jest ZARÓWNO wodorotlenkiem, JAK i zasadą.
Amoniak (NH₃) jest ZASADĄ, ale NIE jest wodorotlenkiem.
Podsumowanie
Wodorotlenki:
- Związki chemiczne z grupą OH⁻.
- Budowa jonowa (metal + OH⁻).
- Przykłady: NaOH, KOH, Ca(OH)₂.
Zasady:
- Substancje zwiększające stężenie OH⁻ w roztworze.
- Akceptory protonów (H⁺) lub donory par elektronowych.
- Przykłady: NaOH, KOH, NH₃, aminy.
Kluczowa różnica:
- Wszystkie wodorotlenki (metali alkalicznych i ziem alkalicznych) są zasadami.
- Nie wszystkie zasady są wodorotlenkami (np. amoniak).
Mam nadzieję, że teraz lepiej rozumiesz różnicę! Powodzenia na egzaminie! Pamiętaj, że praktyka czyni mistrza, więc rozwiązuj zadania i powtarzaj materiał.
Trzymam kciuki!