Określanie liczby elektronów walencyjnych jest kluczowe dla zrozumienia, jak atomy łączą się ze sobą, tworząc związki chemiczne. Te elektrony, znajdujące się na najbardziej zewnętrznej powłoce elektronowej atomu, determinują jego zdolność do tworzenia wiązań. Zrozumienie tego procesu ułatwia przewidywanie właściwości chemicznych pierwiastków i związków.
Co to są elektrony walencyjne?
Elektrony walencyjne to elektrony znajdujące się na ostatniej, najbardziej zewnętrznej powłoce elektronowej atomu. Powłoka ta nazywana jest powłoką walencyjną. Elektrony te są najważniejsze, ponieważ uczestniczą w tworzeniu wiązań chemicznych z innymi atomami. To one decydują o reaktywności chemicznej danego pierwiastka.
Liczba elektronów walencyjnych atomu wpływa na jego zdolność do oddawania, przyjmowania lub współdzielenia elektronów. Proces ten ma na celu uzyskanie przez atom stabilnej konfiguracji elektronowej. Najczęściej jest to oktet elektronowy, czyli posiadanie ośmiu elektronów na powłoce walencyjnej. Wyjątkiem jest wodór i hel, które dążą do duetu elektronowego (2 elektrony).
Jak określić liczbę elektronów walencyjnych?
Istnieją dwa główne sposoby określania liczby elektronów walencyjnych. Pierwszy opiera się na położeniu pierwiastka w układzie okresowym. Drugi sposób wymaga znajomości konfiguracji elektronowej atomu.
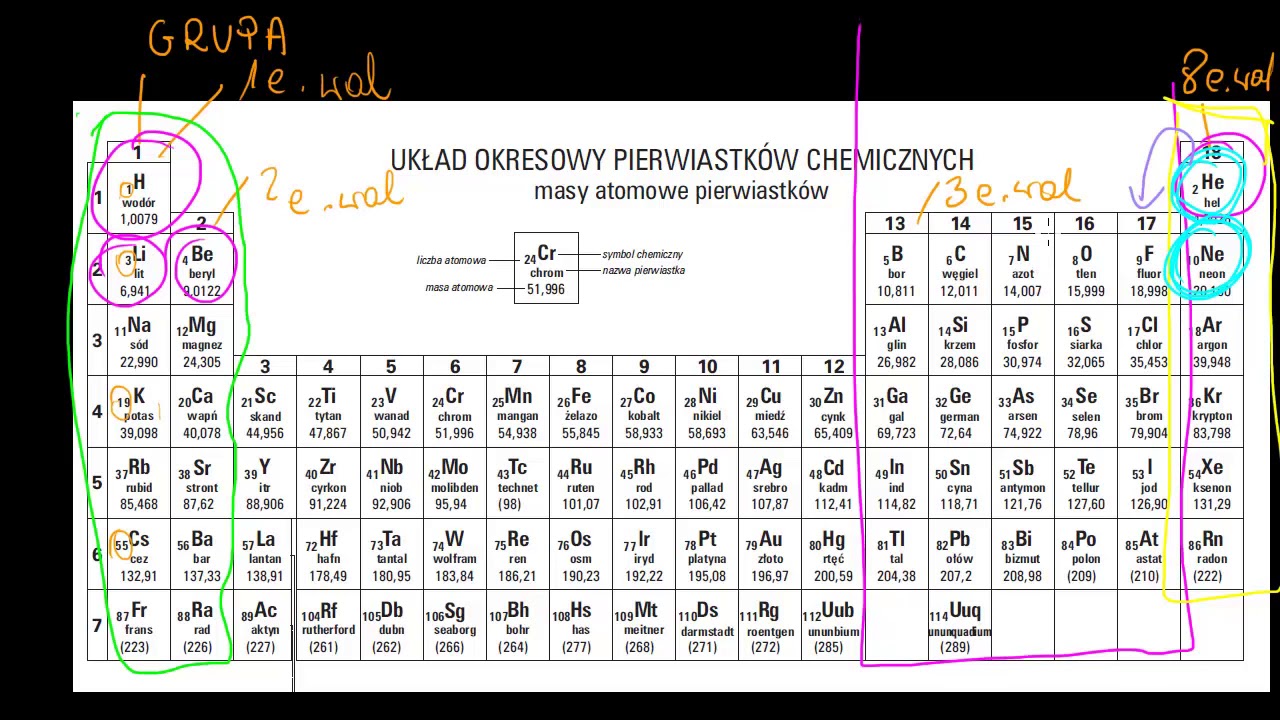
Określanie liczby elektronów walencyjnych na podstawie układu okresowego
Układ okresowy jest zorganizowany w grupy (kolumny) i okresy (rzędy). Liczba elektronów walencyjnych dla pierwiastków z głównych grup (1, 2 i 13-18) jest zazwyczaj równa numerowi grupy. Na przykład, pierwiastki z grupy 1 (np. sód, potas) mają 1 elektron walencyjny, pierwiastki z grupy 2 (np. magnez, wapń) mają 2 elektrony walencyjne.
Wyjątkiem są pierwiastki z grup 13-18. Aby określić liczbę elektronów walencyjnych dla tych grup, odejmujemy od numeru grupy liczbę 10. Na przykład, pierwiastki z grupy 16 (np. tlen, siarka) mają 16 - 10 = 6 elektronów walencyjnych. Podsumowując, patrzymy na ostatnią cyfrę numeru grupy, np. dla grupy 17 elektrony walencyjne to 7.
Pierwiastki przejściowe (grupy 3-12) mają bardziej złożoną konfigurację elektronową i trudniej jest określić liczbę elektronów walencyjnych tylko na podstawie numeru grupy. W wielu przypadkach mają one 2 elektrony walencyjne, ale liczba ta może się różnić w zależności od danego pierwiastka i związku, w którym się znajduje.
Określanie liczby elektronów walencyjnych na podstawie konfiguracji elektronowej
Konfiguracja elektronowa atomu opisuje rozmieszczenie elektronów na poszczególnych powłokach i podpowłokach. Aby określić liczbę elektronów walencyjnych na podstawie konfiguracji elektronowej, należy zidentyfikować najwyższą, numerowaną powłokę elektronową i zsumować wszystkie elektrony na tej powłoce.
Na przykład, konfiguracja elektronowa tlenu (O) to 1s22s22p4. Najwyższą powłoką jest powłoka 2 (2s i 2p). Tlen ma 2 elektrony na podpowłoce 2s i 4 elektrony na podpowłoce 2p. Zatem, tlen ma 2 + 4 = 6 elektronów walencyjnych.
Innym przykładem jest sód (Na), którego konfiguracja elektronowa to 1s22s22p63s1. Najwyższą powłoką jest powłoka 3 (3s). Sód ma tylko 1 elektron na powłoce 3s, więc ma 1 elektron walencyjny.
Przykłady
Wodór (H): Położony w grupie 1, ma 1 elektron walencyjny. Jego konfiguracja elektronowa to 1s1, co również potwierdza 1 elektron walencyjny.
Magnez (Mg): Położony w grupie 2, ma 2 elektrony walencyjne. Jego konfiguracja elektronowa to 1s22s22p63s2, co również potwierdza 2 elektrony walencyjne.
Chlor (Cl): Położony w grupie 17, ma 7 elektronów walencyjnych (17 - 10 = 7). Jego konfiguracja elektronowa to 1s22s22p63s23p5, co również potwierdza 7 elektronów walencyjnych (2 na 3s i 5 na 3p).
Krzem (Si): Położony w grupie 14, ma 4 elektrony walencyjne (14-10=4). Konfiguracja elektronowa to 1s22s22p63s23p2.
Znaczenie elektronów walencyjnych
Znajomość liczby elektronów walencyjnych pozwala przewidywać, jak atomy będą łączyć się ze sobą. Atomy dążą do uzyskania stabilnej konfiguracji elektronowej, zazwyczaj oktetu elektronowego. W tym celu mogą oddawać, przyjmować lub współdzielić elektrony walencyjne, tworząc wiązania chemiczne.
Na przykład, sód (Na) ma 1 elektron walencyjny i chętnie go oddaje, tworząc jon Na+ o stabilnej konfiguracji elektronowej. Chlor (Cl) ma 7 elektronów walencyjnych i chętnie przyjmuje 1 elektron, tworząc jon Cl- o stabilnej konfiguracji elektronowej. Sód i chlor mogą łączyć się, tworząc związek jonowy, chlorek sodu (NaCl), w którym sód oddaje swój elektron chlorowi.
Elektrony walencyjne odgrywają kluczową rolę w reakcjach chemicznych. To dzięki nim możemy zrozumieć, dlaczego niektóre reakcje zachodzą, a inne nie. Określenie liczby elektronów walencyjnych jest podstawą do zrozumienia mechanizmów reakcji chemicznych i właściwości związków chemicznych. Zatem zrozumienie tego konceptu jest fundamentem dla dalszego kształcenia z chemii.