Chemia organiczna może wydawać się skomplikowana. Na szczęście, zrozumienie podstawowych pojęć, takich jak różnica między alkoholami monohydroksylowymi i polihydroksylowymi, jest łatwiejsze niż myślisz. Zaczynajmy!
Czym w ogóle są alkohole?
Alkohole to związki organiczne. Charakteryzują się obecnością grupy hydroksylowej (-OH) w swojej strukturze.
Ta grupa hydroksylowa jest przyłączona do atomu węgla. Ten węgiel tworzy wiązania z innymi atomami węgla i wodoru.
Alkohol powstaje, gdy atom wodoru w węglowodorze zastąpimy grupą hydroksylową.
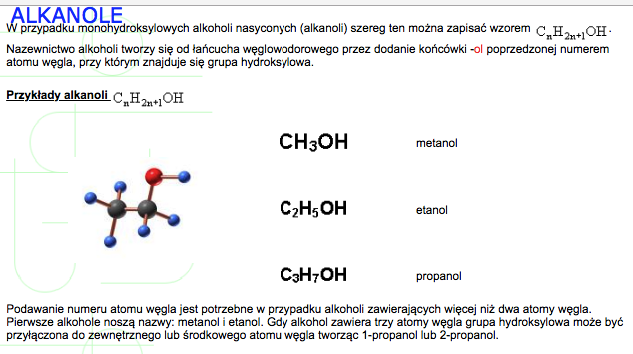
Przykład? Mamy metan (CH4). Zastępujemy jeden atom wodoru grupą -OH i otrzymujemy metanol (CH3OH).
Alkohole monohydroksylowe: jeden "OH" wystarczy!
Alkohole monohydroksylowe, nazywane również alkoholami jednohydroksylowymi, to takie alkohole. Mają tylko jedną grupę hydroksylową (-OH) w cząsteczce.
Pomyśl o nich jako o alkoholach "jednogrupowych".
Przykłady?
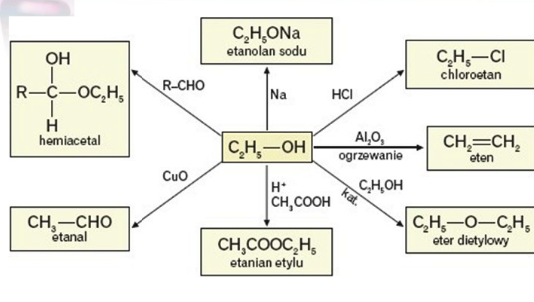
- Etanol (C2H5OH): Znany jako alkohol etylowy, obecny w napojach alkoholowych. Używany również jako rozpuszczalnik i środek dezynfekujący.
- Metanol (CH3OH): Alkohol metylowy. Jest bardzo toksyczny! Używany w przemyśle jako rozpuszczalnik i surowiec do produkcji innych chemikaliów.
- Propanol (C3H7OH): Alkohol propylowy. Stosowany jako rozpuszczalnik i w środkach czyszczących.
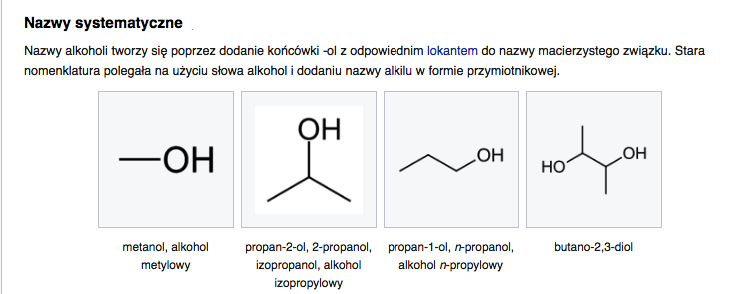
Wzór ogólny alkoholi monohydroksylowych to R-OH, gdzie R to grupa alkilowa (np. metyl, etyl, propyl).
Alkohole polihydroksylowe: im więcej, tym "weselej"?
Alkohole polihydroksylowe (lub wielohydroksylowe) to alkohole. Mają więcej niż jedną grupę hydroksylową (-OH) w swojej cząsteczce.
Czyli, mają co najmniej dwie grupy -OH.
Dlatego nazywamy je "wielogrupowymi".
Przykłady?
- Glikol etylenowy (C2H4(OH)2): Ma dwie grupy -OH. Jest stosowany jako płyn niezamarzający w chłodnicach samochodowych. Jest toksyczny!
- Glicerol (C3H5(OH)3): Ma trzy grupy -OH. Znany również jako gliceryna. Stosowany w kosmetykach, mydłach i lekach. Nawilża skórę.
- Sorbitol (C6H14O6): Ma aż sześć grup -OH! Jest stosowany jako słodzik w produktach "sugar-free".
Jak je rozróżnić? Kluczowe różnice.
Najważniejsza różnica: liczba grup hydroksylowych (-OH).
Alkohole monohydroksylowe: jedna grupa -OH.
Alkohole polihydroksylowe: więcej niż jedna grupa -OH.
Właściwości fizyczne
Obecność wielu grup -OH wpływa na właściwości fizyczne alkoholi polihydroksylowych. Mają one wyższą temperaturę wrzenia i są bardziej rozpuszczalne w wodzie niż alkohole monohydroksylowe o podobnej masie cząsteczkowej.
Dlaczego? Grupy -OH tworzą wiązania wodorowe. Więcej grup -OH = więcej wiązań wodorowych.
Więcej wiązań wodorowych = wyższa temperatura wrzenia (potrzeba więcej energii, aby je zerwać).
Więcej wiązań wodorowych = lepsza rozpuszczalność w wodzie (woda też tworzy wiązania wodorowe).
Właściwości chemiczne
Liczba grup -OH wpływa także na reaktywność chemiczną alkoholi. Alkohole polihydroksylowe mogą brać udział w większej liczbie reakcji niż monohydroksylowe. Potrafią tworzyć złożone struktury.
Na przykład, glicerol (alkohol trihydroksylowy) może estryfikować się z trzema cząsteczkami kwasów tłuszczowych. W ten sposób powstają tłuszcze.
Zastosowania
Różnice we właściwościach fizycznych i chemicznych przekładają się na różne zastosowania.
Alkohole monohydroksylowe: Często używane jako rozpuszczalniki, paliwa i środki dezynfekujące (np. etanol).
Alkohole polihydroksylowe: Często używane jako środki nawilżające (glicerol), płyny niezamarzające (glikol etylenowy) i słodziki (sorbitol).
Podsumowanie w punktach: Jak je rozróżnić?
- Liczba grup -OH: To najważniejsze kryterium. Monohydroksylowe mają jedną, polihydroksylowe mają więcej.
- Właściwości fizyczne: Polihydroksylowe mają wyższą temperaturę wrzenia i lepszą rozpuszczalność w wodzie.
- Właściwości chemiczne: Polihydroksylowe są bardziej reaktywne i mogą brać udział w większej liczbie reakcji.
- Zastosowania: Różne zastosowania wynikają z różnic we właściwościach.
Pamiętaj: nazewnictwo jest ważne. Nazwa alkohol monohydroksylowy lub polihydroksylowy mówi nam o strukturze związku.
Zrozumienie tych podstawowych różnic pomoże Ci lepiej zrozumieć chemię organiczną. Powodzenia!