Hej! Przygotowujesz się do egzaminu z chemii i masz problem z odczytywaniem wartościowości z układu okresowego? Bez obaw, pomogę Ci to zrozumieć krok po kroku. To wcale nie jest takie trudne, jak się wydaje!
Czym jest wartościowość?
Wartościowość to liczba wiązań chemicznych, jakie dany atom może utworzyć z innymi atomami. Można to rozumieć jako "zdolność łączenia się".
Im wyższa wartościowość, tym więcej "rąk" do łączenia się ma dany atom.
Jak odczytywać wartościowości z układu okresowego?
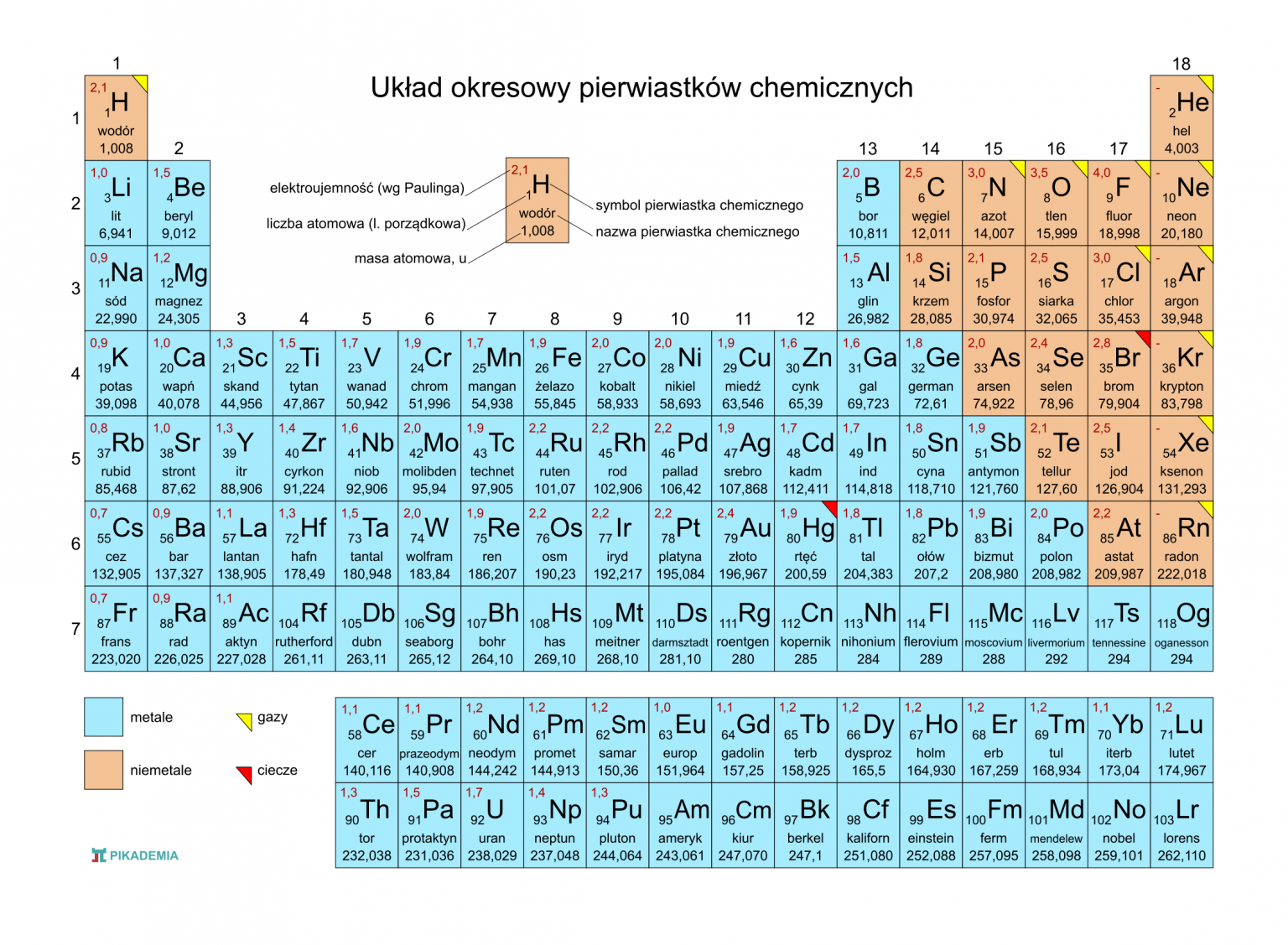
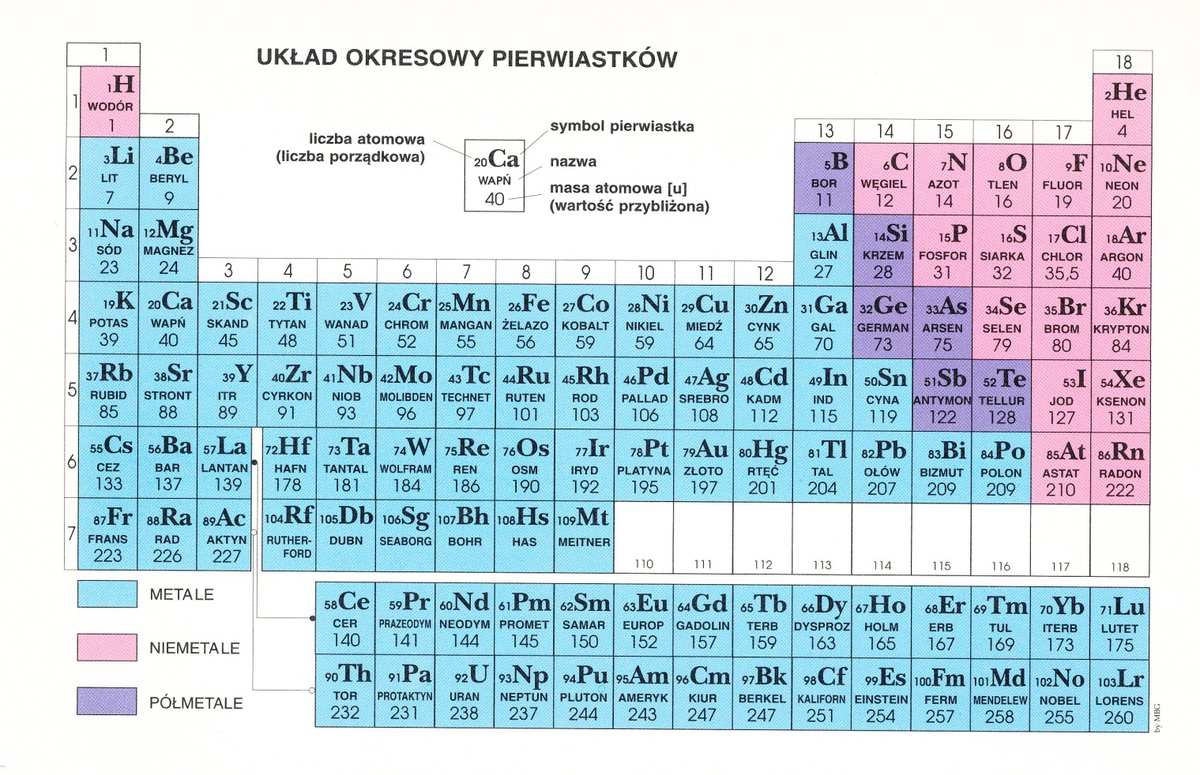
Układ okresowy to Twoja ściągawka! Wiele informacji możesz z niego wyczytać.
Grupy główne
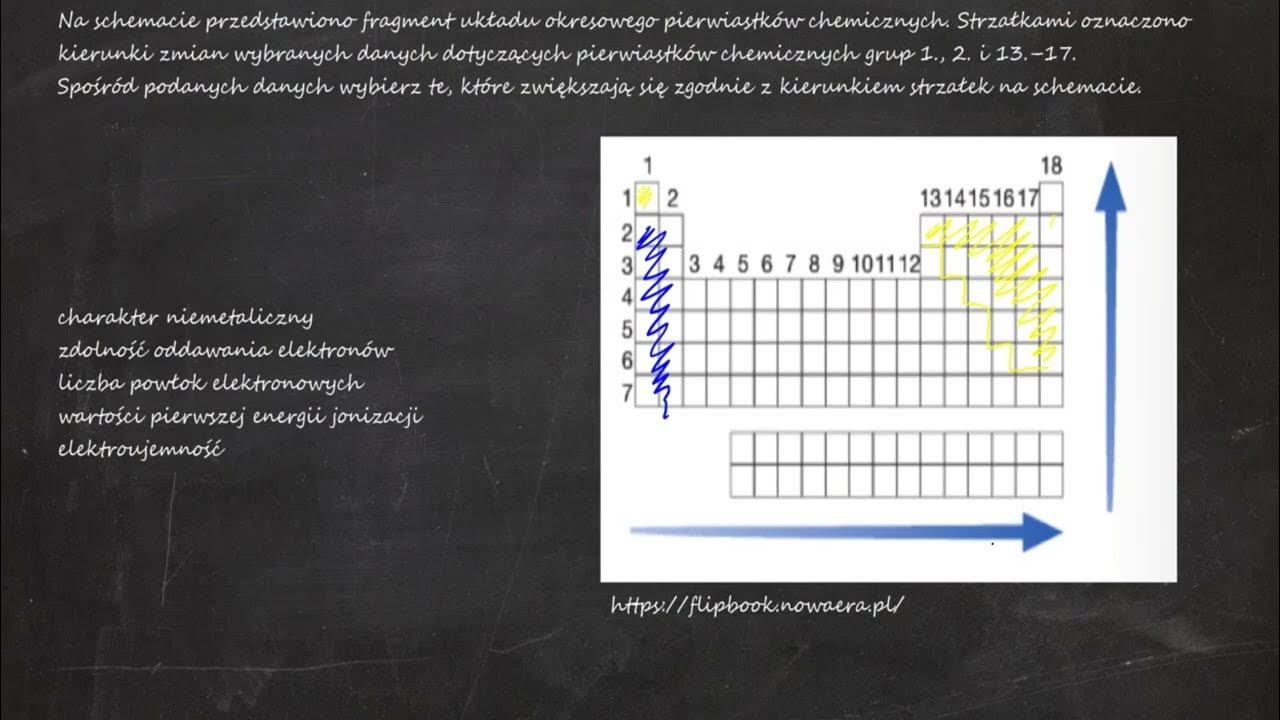
Najprościej jest zacząć od grup głównych, czyli grup 1, 2 oraz 13-17. To kolumny w układzie okresowym.
Dla tych grup istnieje dość prosta zależność między numerem grupy a wartościowością:
- Grupa 1 (litowce): Zazwyczaj wartościowość I. Przykład: Sód (Na) tworzy związki, w których ma wartościowość I.
- Grupa 2 (berylowce): Zazwyczaj wartościowość II. Przykład: Magnez (Mg) ma wartościowość II.
- Grupa 13 (borowce): Zazwyczaj wartościowość III. Przykład: Glin (Al) ma wartościowość III.
- Grupa 14 (węglowce): Zazwyczaj wartościowość IV. Przykład: Węgiel (C) ma wartościowość IV.
- Grupa 15 (azotowce): Zazwyczaj wartościowość III i V. Przykład: Azot (N) może mieć wartościowość III (np. w amoniaku NH3) lub V (np. w tlenku azotu(V) N2O5).
- Grupa 16 (tlenowce): Zazwyczaj wartościowość II. Przykład: Tlen (O) ma wartościowość II.
- Grupa 17 (halogenowce): Zazwyczaj wartościowość I. Przykład: Chlor (Cl) ma wartościowość I.
- Grupa 18 (helowce): Są to gazy szlachetne. Zazwyczaj nie tworzą związków (wartościowość 0), chociaż niektóre z nich mogą tworzyć związki w ekstremalnych warunkach.
Zauważ, że dla grup 15-17 często występuje więcej niż jedna możliwa wartościowość. To wynika z ich konfiguracji elektronowej.
Metale przejściowe
Metale przejściowe (grupy 3-12) są nieco bardziej skomplikowane. Często wykazują więcej niż jedną wartościowość. Wartościowości te zależą od konkretnego związku.
Przykłady:
- Żelazo (Fe): Może mieć wartościowość II (np. w FeCl2) lub III (np. w FeCl3).
- Miedź (Cu): Może mieć wartościowość I (np. w CuCl) lub II (np. w CuO).
W przypadku metali przejściowych często trzeba sprawdzić wartościowość w konkretnym związku, znając wzór chemiczny i wartościowości innych atomów w tym związku.
Jak ustalić wartościowość w danym związku?
Aby ustalić wartościowość pierwiastka w danym związku, skorzystaj z następujących zasad:
- Wartościowość tlenu w tlenkach wynosi zazwyczaj II.
- Wartościowość wodoru w związkach z niemetalami wynosi zazwyczaj I.
- Suma wartościowości wszystkich atomów w cząsteczce obojętnej elektrycznie musi wynosić zero.
- W jonie, suma wartościowości atomów musi być równa ładunkowi jonu.
Przykład:
Chcesz ustalić wartościowość siarki (S) w związku SO3. Wiesz, że tlen (O) ma wartościowość II. Zatem:
x + 3*(-II) = 0
x - 6 = 0
x = +VI
Zatem siarka (S) w SO3 ma wartościowość VI.
Wyjątki
Pamiętaj, że w chemii zawsze są wyjątki! Niektóre pierwiastki mogą wykazywać nietypowe wartościowości w specyficznych związkach. Jednak na poziomie egzaminu, zazwyczaj możesz polegać na ogólnych zasadach.
Praktyka czyni mistrza!
Najlepszym sposobem na opanowanie odczytywania wartościowości jest rozwiązywanie zadań. Im więcej przykładów przeanalizujesz, tym łatwiej będzie Ci to przychodziło.
Spróbuj określić wartościowości pierwiastków w następujących związkach:
- H2O
- CO2
- NaCl
- KMnO4
Podsumowanie
Oto kluczowe punkty:
- Wartościowość to liczba wiązań chemicznych, jakie atom może utworzyć.
- Dla grup głównych, wartościowość często wynika z numeru grupy.
- Metale przejściowe mogą mieć wiele wartościowości.
- Ustalając wartościowość w związku, pamiętaj o zasadach sumy wartościowości.
- Ćwicz, ćwicz i jeszcze raz ćwicz!
Powodzenia na egzaminie! Pamiętaj, że dasz radę! Jeśli będziesz mieć pytania, nie wahaj się pytać. Trzymam kciuki!