Hej! Chcesz wiedzieć, jak obliczyć stężenie roztworu? Zaraz się dowiesz! Pokażemy to w prosty i wizualny sposób.
Wyobraź sobie, że robisz herbatę. Mocna, słaba, średnia – to wszystko zależy od stężenia.
Co to właściwie jest stężenie roztworu?
To tak, jakbyś pytał, ile cukru jest w szklance wody.
Stężenie roztworu mówi nam, ile substancji rozpuszczonej znajduje się w rozpuszczalniku.
Substancja rozpuszczona to na przykład cukier, sól, albo… aromat herbaty. To coś, co się rozpuszcza.
Rozpuszczalnik to zwykle woda, ale może to być też alkohol, aceton, i wiele innych płynów. To w nim coś się rozpuszcza.
Roztwór to mieszanina rozpuszczalnika i substancji rozpuszczonej. Herbatka to idealny przykład!
Rodzaje stężeń
Istnieje kilka sposobów na wyrażenie stężenia roztworu. Pokażemy dwa najpopularniejsze:
Stężenie procentowe (%):
To jak powiedzieć, ile procent roztworu stanowi substancja rozpuszczona.
Wyobraź sobie tort. Jeśli wytniesz z niego kawałek, powiedzmy 20%, to właśnie masz stężenie procentowe.
Wzór: % = (masa substancji rozpuszczonej / masa roztworu) * 100%
Masa roztworu to masa substancji rozpuszczonej plus masa rozpuszczalnika.
Przykład: Masz 10g soli i rozpuszczasz ją w 90g wody. Masa roztworu to 10g + 90g = 100g. Stężenie procentowe to (10g / 100g) * 100% = 10%. Czyli masz roztwór 10%.
Pamiętaj: masa roztworu jest bardzo ważna!
Pomyśl o soku pomarańczowym. Jeśli dodasz 100 ml soku do 900 ml wody, uzyskasz roztwór o stężeniu około 10% (zakładając, że gęstość soku jest zbliżona do gęstości wody).
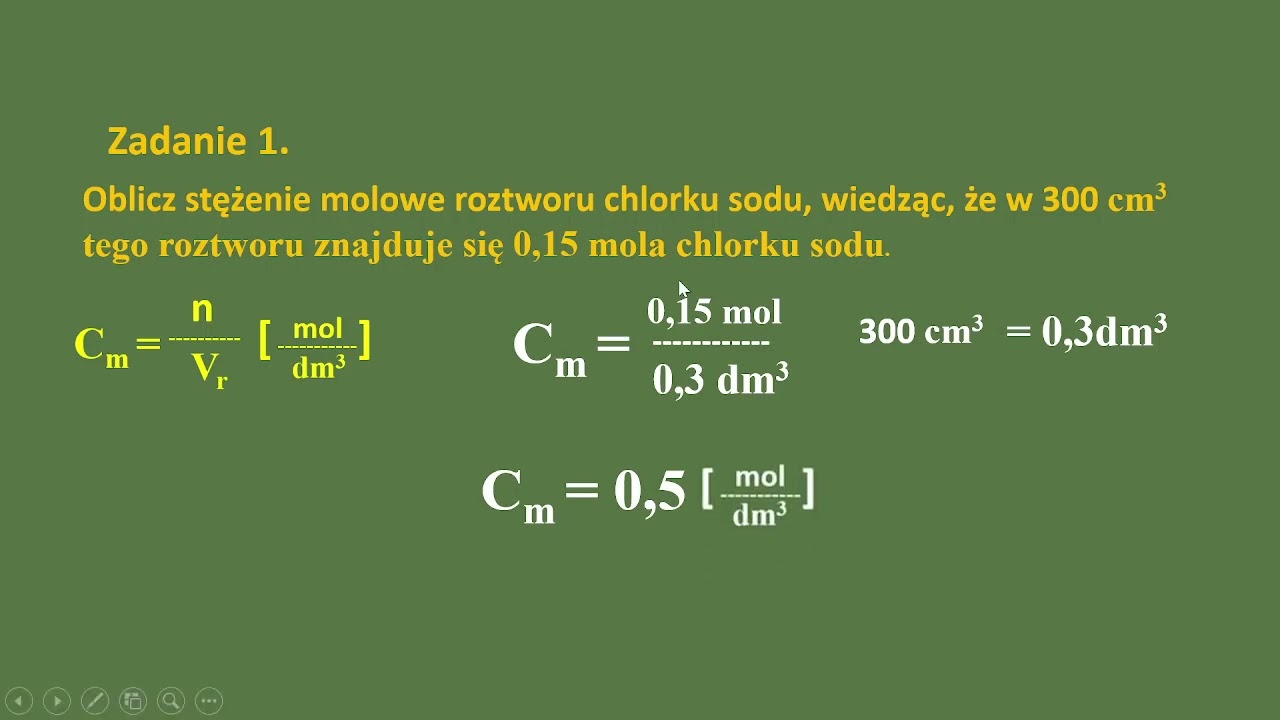
Stężenie molowe (mol/dm3 lub M):
To trochę bardziej skomplikowane, ale nie bój się! Postaramy się to uprościć.
Mol to jednostka ilości substancji. Wyobraź sobie, że mol to paczka jajek. Zawsze jest w niej taka sama ilość jajek (w przypadku mola – atomów, cząsteczek, jonów). Ta liczba to liczba Avogadro (około 6,022 x 1023).
Stężenie molowe mówi nam, ile moli substancji rozpuszczonej znajduje się w jednym decymetrze sześciennym (dm3) roztworu. Jeden decymetr sześcienny to jeden litr (L).
Wzór: Stężenie molowe (C) = liczba moli substancji rozpuszczonej (n) / objętość roztworu (V)
Przykład: Masz 1 mol soli i rozpuszczasz go w wodzie, tak żeby otrzymać 1 litr roztworu. Stężenie molowe tego roztworu to 1 mol/L (albo 1M).
Żeby obliczyć liczbę moli, potrzebujesz masy molowej substancji. To masa jednego mola danej substancji. Możesz ją znaleźć w układzie okresowym pierwiastków albo w internecie.
Przykład: Chcesz przygotować 0,5 L roztworu NaCl o stężeniu 0,1 mol/L. Jak to zrobić?
- Oblicz, ile moli NaCl potrzebujesz: n = C * V = 0,1 mol/L * 0,5 L = 0,05 mola
- Znajdź masę molową NaCl: Na (22.99 g/mol) + Cl (35.45 g/mol) = 58.44 g/mol
- Oblicz masę NaCl, którą musisz odważyć: masa = n * masa molowa = 0,05 mola * 58.44 g/mol = 2.922 g
Czyli musisz odważyć 2.922 g soli NaCl, rozpuścić ją w wodzie, i dopełnić wodą do objętości 0,5 L. I gotowe! Masz roztwór o stężeniu 0,1 mol/L.
Praktyczne wskazówki
Uważaj na jednostki! Zawsze sprawdź, czy używasz odpowiednich jednostek (gramy, kilogramy, litry, decymetry sześcienne).
Masa roztworu to masa substancji rozpuszczonej plus masa rozpuszczalnika.
Pamiętaj o masie molowej, jeśli obliczasz stężenie molowe.
Ćwicz! Im więcej zadań rozwiążesz, tym lepiej zrozumiesz te zagadnienia.
Używaj kalkulatora! Obliczenia mogą być żmudne, ale kalkulator bardzo pomaga.
Pamiętaj, że stężenie to po prostu proporcja. Im więcej substancji rozpuszczonej, tym wyższe stężenie.
Teraz już wiesz, jak obliczyć stężenie roztworu! Powodzenia!