Elektrony walencyjne to elektrony znajdujące się na zewnętrznej powłoce atomu. Są one kluczowe dla zrozumienia, jak atomy łączą się ze sobą tworząc związki chemiczne. Określenie ich liczby jest fundamentalne dla przewidywania właściwości chemicznych pierwiastków.
Jak zidentyfikować grupę pierwiastka
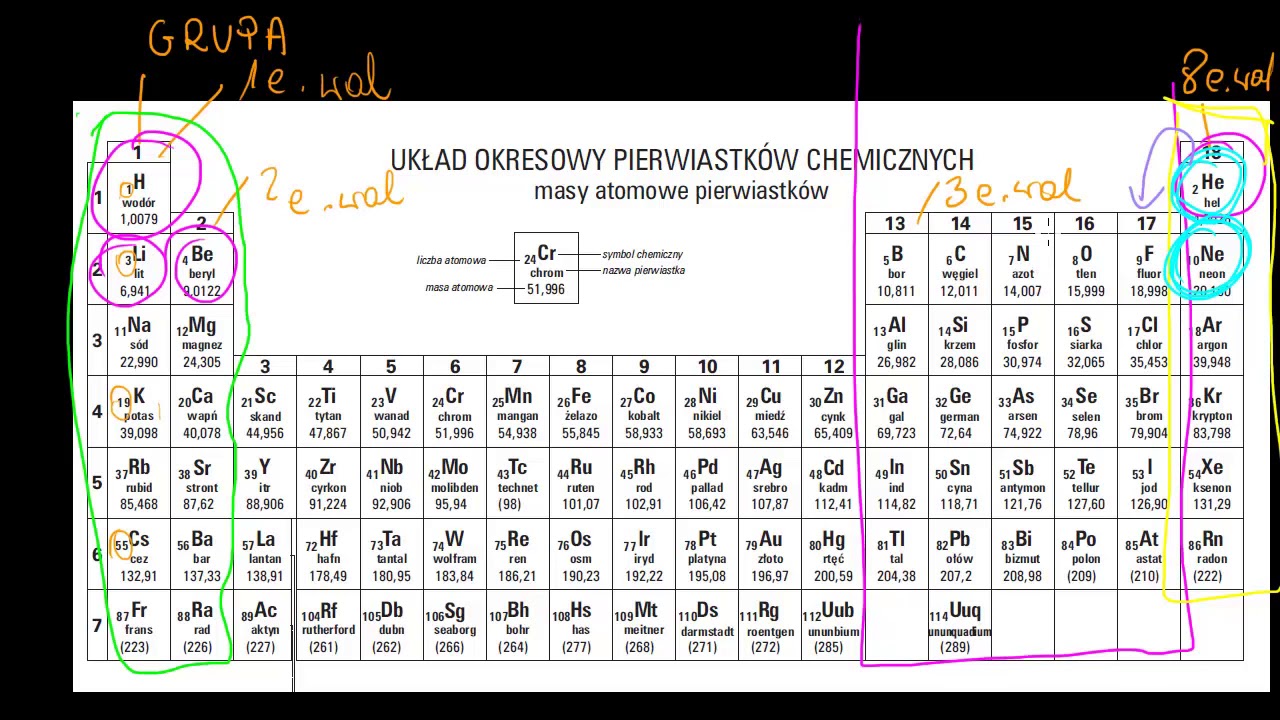
Aby określić liczbę elektronów walencyjnych, na początek musimy zlokalizować pierwiastek w układzie okresowym. Układ okresowy jest zorganizowany w grupy (kolumny pionowe) i okresy (rzędy poziome). Numer grupy często (choć nie zawsze!) bezpośrednio wskazuje liczbę elektronów walencyjnych.
Grupy są numerowane od 1 do 18. Należy jednak pamiętać, że dla pierwiastków grup głównych (czyli tych z grupy 1, 2 oraz 13-18) sprawa jest prostsza. Pierwiastki z grup 3-12 (metale przejściowe) mają bardziej skomplikowaną konfigurację elektronową.
Na przykład, sód (Na) znajduje się w grupie 1. To oznacza, że ma jeden elektron walencyjny. Z kolei tlen (O) jest w grupie 16, co oznacza, że ma sześć elektronów walencyjnych. Pamiętajmy, że numer grupy odejmujemy od 10 w przypadku grup 13-17, aby uzyskać liczbę elektronów walencyjnych (np. grupa 16: 16-10=6).
Związek konfiguracji elektronowej z elektronami walencyjnymi
Konfiguracja elektronowa opisuje, jak elektrony są rozmieszczone na różnych poziomach energetycznych i podpoziomach (orbitale s, p, d, f) w atomie. Elektrony walencyjne to te, które znajdują się na najwyższym poziomie energetycznym (czyli w powłoce walencyjnej).
Rozważmy węgiel (C), który ma liczbę atomową 6. Jego konfiguracja elektronowa to 1s22s22p2. Najwyższy poziom energetyczny to 2, a na nim znajdują się 2 elektrony na podpowłoce 2s i 2 elektrony na podpowłoce 2p. Zatem węgiel ma 2 + 2 = 4 elektrony walencyjne, co zgadza się z jego położeniem w grupie 14 układu okresowego (14-10=4).
Inny przykład: chlor (Cl), liczba atomowa 17, konfiguracja elektronowa 1s22s22p63s23p5. Najwyższy poziom energetyczny to 3. Na tym poziomie znajduje się 2 elektrony na podpowłoce 3s i 5 elektronów na podpowłoce 3p. Łącznie daje to 2 + 5 = 7 elektronów walencyjnych. Chlor znajduje się w grupie 17 (17-10=7).
Wyjątki i komplikacje
Dla metali przejściowych sytuacja jest bardziej złożona. Elektrony walencyjne mogą obejmować również elektrony z niepełnej podpowłoki d. Dlatego przewidywanie liczby elektronów walencyjnych dla metali przejściowych jedynie na podstawie numeru grupy jest często niemożliwe.
Ponadto, niektóre pierwiastki, szczególnie te na granicy między metalami i niemetalami (półmetale), mogą wykazywać różne liczby elektronów walencyjnych w zależności od związku, w którym występują. Takie zachowanie wynika z faktu, że energia potrzebna do usunięcia elektronów z kolejnych powłok jest zbliżona.
Na przykład, cyna (Sn) może występować na stopniach utlenienia +2 i +4. To oznacza, że w niektórych związkach oddaje 2 elektrony (czyli 2 elektrony walencyjne biorą udział w wiązaniu), a w innych 4 (co odpowiada liczbie elektronów walencyjnych wynikającej z jego położenia w grupie 14).
Znaczenie elektronów walencyjnych
Liczba elektronów walencyjnych determinuje zdolność atomu do tworzenia wiązań chemicznych. Atomy dążą do osiągnięcia konfiguracji elektronowej najbliższej gazowi szlachetnemu (8 elektronów walencyjnych, z wyjątkiem helu, który ma 2). Jest to znane jako reguła oktetu (lub dubletu dla helu).
Atomy mogą osiągnąć oktet poprzez oddawanie, przyjmowanie lub współdzielenie elektronów. Na przykład, sód (1 elektron walencyjny) chętnie oddaje swój jeden elektron, aby stać się jonem Na+ z pełną powłoką walencyjną. Chlor (7 elektronów walencyjnych) chętnie przyjmuje jeden elektron, aby stać się jonem Cl-.
Związki takie jak chlorek sodu (NaCl) powstają, gdy sód oddaje elektron chlorowi. Inne związki, jak np. woda (H2O), powstają poprzez współdzielenie elektronów między atomami. Liczba elektronów walencyjnych pozwala przewidzieć, jakie wiązania powstaną i jaka będzie struktura cząsteczki.
Podsumowanie
Określenie liczby elektronów walencyjnych jest kluczowe dla zrozumienia właściwości chemicznych pierwiastków i ich zdolności do tworzenia związków. Dla pierwiastków grup głównych, numer grupy (lub numer grupy minus 10 dla grup 13-17) w układzie okresowym bezpośrednio wskazuje liczbę elektronów walencyjnych. Pamiętaj, że dla metali przejściowych i niektórych innych pierwiastków sytuacja jest bardziej skomplikowana i wymaga uwzględnienia konfiguracji elektronowej.