Hej! Zbliża się egzamin z chemii? Nie martw się! Pomożemy Ci zrozumieć, jak obliczać kationy i aniony. To wcale nie jest takie trudne, jak się wydaje.
Czym są Kationy i Aniony?
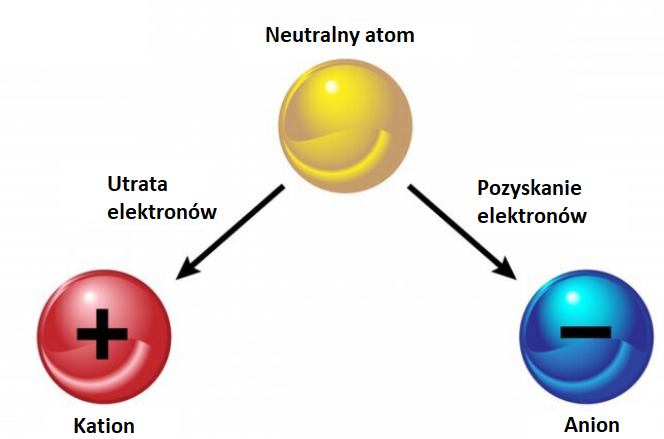
Najpierw, przypomnijmy sobie podstawy. Atom jest elektrycznie obojętny. Ma tyle samo protonów (ładunek dodatni) i elektronów (ładunek ujemny). Zdarza się jednak, że atom traci lub zyskuje elektrony.
Jeśli atom traci elektrony, staje się kationem. Kation ma ładunek dodatni. Pamiętaj: "ka-tion" – "ka" jak "kot", który jest pozytywny i przyjazny! Na przykład, atom sodu (Na) traci jeden elektron i staje się kationem Na+.
Jeśli atom zyskuje elektrony, staje się anionem. Anion ma ładunek ujemny. Pamiętaj: "a-nion" – "a" jak "anty" (przeciwny), czyli przeciwny do dodatniego! Na przykład, atom chloru (Cl) zyskuje jeden elektron i staje się anionem Cl-.
Jak Obliczyć Ładunek Kationu i Anionu?
Obliczanie ładunku jest proste. Liczba utraconych lub zyskanych elektronów odpowiada ładunkowi jonu. Ładunek piszemy w prawym górnym rogu symbolu pierwiastka.
Kationy: Określ, ile elektronów atom stracił. Liczba ta będzie ładunkiem dodatnim. Na przykład: Mg2+ oznacza, że atom magnezu stracił 2 elektrony. Al3+ oznacza, że atom glinu stracił 3 elektrony. Im więcej elektronów atom straci, tym większy ładunek dodatni posiada.
Aniony: Określ, ile elektronów atom zyskał. Liczba ta będzie ładunkiem ujemnym. Na przykład: O2- oznacza, że atom tlenu zyskał 2 elektrony. F- oznacza, że atom fluoru zyskał 1 elektron. Im więcej elektronów atom zyska, tym większy ładunek ujemny posiada.
Przykłady
Zobaczmy kilka przykładów. Potas (K) zwykle tworzy jon K+. To oznacza, że stracił jeden elektron. Wapń (Ca) tworzy jon Ca2+, tracąc dwa elektrony.
Siarka (S) często tworzy jon S2-. To oznacza, że zyskała dwa elektrony. Azot (N) może tworzyć jon N3-, zyskując trzy elektrony.
Zapamiętaj!
Kationy mają ładunek dodatni (tracą elektrony). Aniony mają ładunek ujemny (zyskują elektrony). Liczba utraconych lub zyskanych elektronów odpowiada ładunkowi jonu. Zawsze patrz na ładunek w prawym górnym rogu symbolu pierwiastka.
Pamiętaj, praktyka czyni mistrza! Rozwiązuj zadania, analizuj tablicę Mendelejewa i na pewno dasz radę. Powodzenia na egzaminie! Wierzymy w Ciebie!




%2C+kde..jpg)