Zastanówmy się, ile elektronów walencyjnych ma tlen. To kluczowe pytanie, aby zrozumieć, jak tlen łączy się z innymi atomami. Bez tej wiedzy, trudno zrozumieć świat chemii.
Czym są Elektrony Walencyjne?
Elektrony walencyjne to elektrony znajdujące się na najbardziej zewnętrznej powłoce elektronowej atomu. Powłoka ta nazywana jest powłoką walencyjną. To właśnie te elektrony biorą udział w tworzeniu wiązań chemicznych. Decydują one o tym, jak atom oddziałuje z innymi atomami. Na przykład, atomy z jednym lub dwoma elektronami walencyjnymi często oddają je, tworząc wiązania.
Zrozumienie elektronów walencyjnych pozwala przewidzieć, jakie wiązania chemiczne dany atom może tworzyć. Możemy też przewidzieć właściwości związku chemicznego, wiedząc ile elektronów walencyjnych mają tworzące go atomy. Wiedza o elektronach walencyjnych jest fundamentalna w chemii.
Konfiguracja Elektronowa Tlenu
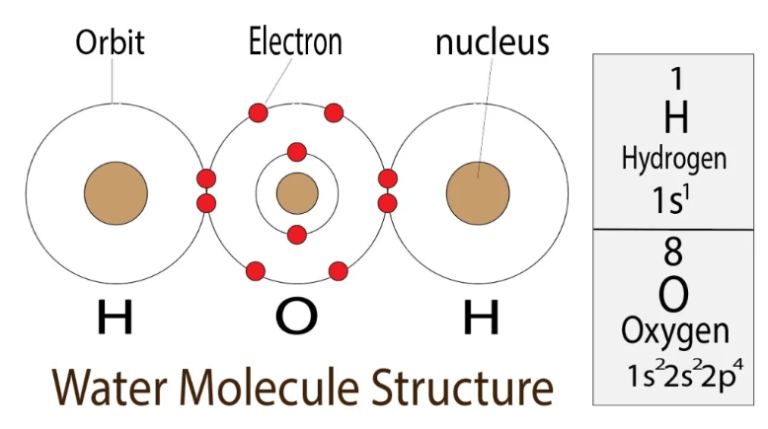
Aby określić liczbę elektronów walencyjnych tlenu, musimy przyjrzeć się jego konfiguracji elektronowej. Tlen ma liczbę atomową 8, co oznacza, że posiada 8 protonów w jądrze i, w stanie neutralnym, 8 elektronów. Elektrony te rozmieszczone są na powłokach elektronowych.
Pierwsza powłoka elektronowa może pomieścić maksymalnie 2 elektrony. Druga powłoka może pomieścić maksymalnie 8 elektronów. Dla tlenu, konfiguracja elektronowa wygląda następująco: 1s² 2s² 2p⁴. Oznacza to, że 2 elektrony znajdują się na powłoce 1s, 2 elektrony na powłoce 2s i 4 elektrony na powłoce 2p.
Powłoka walencyjna to ta, która ma najwyższy numer. W przypadku tlenu, jest to druga powłoka (n=2). Ma ona 2 elektrony na podpowłoce 2s i 4 elektrony na podpowłoce 2p. Sumując te elektrony, otrzymujemy 2 + 4 = 6.
Ile Elektronów Walencyjnych Ma Tlen?
Zatem, tlen ma 6 elektronów walencyjnych. To bardzo ważna informacja. Te sześć elektronów decyduje o sposobie, w jaki tlen tworzy wiązania chemiczne z innymi atomami. To tłumaczy, dlaczego tlen jest tak reaktywnym pierwiastkiem.
Atom dąży do uzyskania oktetu elektronowego, czyli konfiguracji, w której ma 8 elektronów na powłoce walencyjnej. Tlen, mając 6 elektronów walencyjnych, potrzebuje jeszcze 2, aby osiągnąć oktet. Dlatego tlen często tworzy dwa wiązania kowalencyjne.
Przykłady Wiązań Tlenu
Tlen bardzo często tworzy wiązania z innymi atomami. Najbardziej znanym przykładem jest woda (H₂O). W cząsteczce wody, atom tlenu łączy się z dwoma atomami wodoru. Każdy atom wodoru oddaje jeden elektron do współużytkowania, tworząc dwa wiązania kowalencyjne. Dzięki temu tlen uzyskuje oktet elektronowy, a każdy atom wodoru – duplet.
Innym przykładem jest dwutlenek węgla (CO₂). W cząsteczce dwutlenku węgla, atom węgla łączy się z dwoma atomami tlenu. Każdy atom tlenu współdzieli dwa elektrony z atomem węgla, tworząc dwa wiązania podwójne. W ten sposób zarówno węgiel, jak i tlen osiągają oktet elektronowy. To przykład na siłę dążenia tlenu do stanu stabilności.
Tlen tworzy również wiązania jonowe. Przykładem może być tlenek magnezu (MgO). Magnez ma dwa elektrony walencyjne, które oddaje atomowi tlenu. Dzięki temu magnez zyskuje konfigurację gazu szlachetnego (oktet), a tlen również. Powstają jony Mg²⁺ i O²⁻, które przyciągają się elektrostatycznie, tworząc wiązanie jonowe.
Znaczenie Elektronów Walencyjnych Tlenu
Liczba elektronów walencyjnych tlenu ma ogromne znaczenie w wielu dziedzinach. W biologii, tlen jest niezbędny do oddychania komórkowego. Reakcje utleniania, które zachodzą w komórkach, dostarczają energii potrzebnej do życia. To właśnie elektrony walencyjne tlenu umożliwiają te reakcje.
W przemyśle, tlen jest wykorzystywany w wielu procesach. Na przykład, w hutnictwie tlen jest używany do wytapiania stali. W chemii, tlen jest używany jako utleniacz w wielu reakcjach. Zrozumienie elektronów walencyjnych tlenu pozwala na optymalizację tych procesów. To kluczowe dla rozwoju nowoczesnej technologii.
Podsumowując, tlen ma 6 elektronów walencyjnych. Ta liczba decyduje o jego reaktywności i zdolności do tworzenia wiązań chemicznych. Poznanie tej informacji jest fundamentalne dla zrozumienia chemii i jej zastosowań w życiu codziennym.