Określenie liczby elektronów walencyjnych w atomie pierwiastka jest fundamentalne dla zrozumienia jego właściwości chemicznych. Elektrony walencyjne decydują o sposobie, w jaki atom łączy się z innymi atomami, tworząc wiązania chemiczne. W przypadku cynku (Zn), sprawa jest dość specyficzna, co wymaga głębszego zrozumienia jego konfiguracji elektronowej.
Czym są elektrony walencyjne?
Elektrony walencyjne to elektrony znajdujące się na najbardziej zewnętrznej powłoce elektronowej atomu. Ta powłoka nazywana jest powłoką walencyjną. To właśnie te elektrony biorą udział w tworzeniu wiązań chemicznych, czyli w interakcjach z innymi atomami. Atomy dążą do uzyskania stabilnej konfiguracji elektronowej, zwykle odpowiadającej konfiguracji gazu szlachetnego (osiem elektronów na powłoce walencyjnej – reguła oktetu lub dwa elektrony – reguła dubletu).
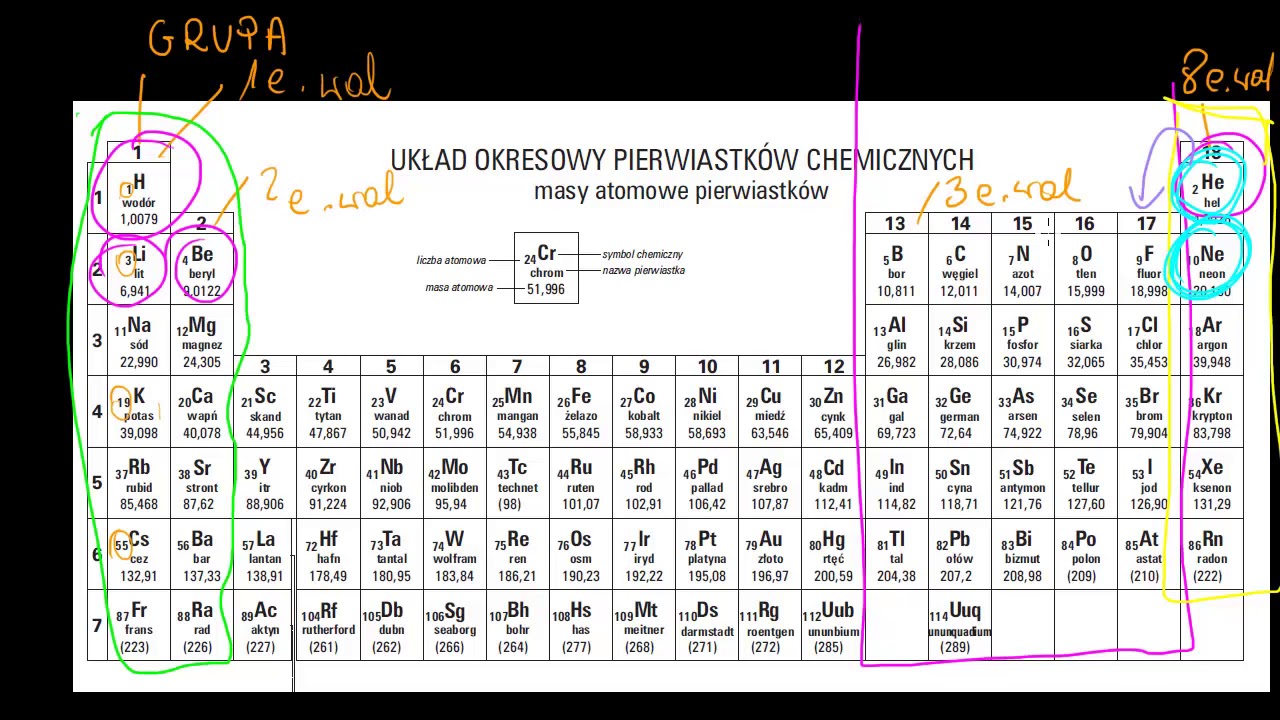
Liczba elektronów walencyjnych danego pierwiastka często, choć nie zawsze, odpowiada numerowi grupy, w której znajduje się on w układzie okresowym. Należy jednak pamiętać o wyjątkach, zwłaszcza w przypadku pierwiastków bloku d, czyli metali przejściowych. Metale przejściowe, w tym cynk, charakteryzują się niepełnymi podpowłokami d, co wpływa na ich zachowanie chemiczne.
Konfiguracja elektronowa cynku
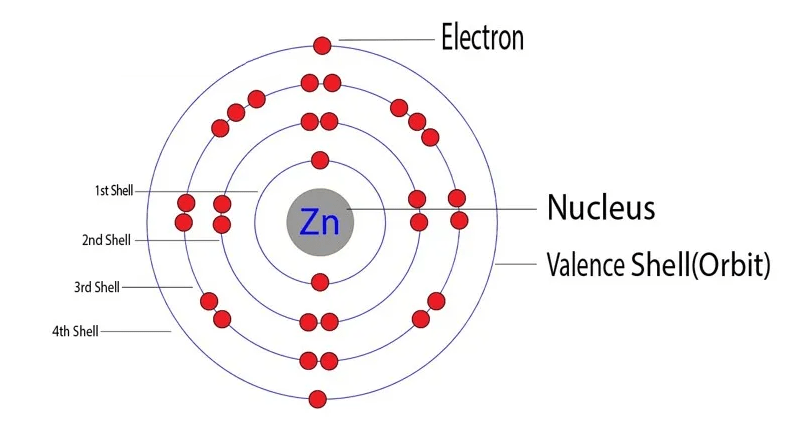
Cynk (Zn) ma liczbę atomową 30, co oznacza, że jego atom zawiera 30 protonów w jądrze i 30 elektronów krążących wokół niego. Konfiguracja elektronowa cynku to 1s2 2s2 2p6 3s2 3p6 4s2 3d10. Można ją również zapisać skrótowo jako [Ar] 4s2 3d10, gdzie [Ar] oznacza konfigurację elektronową argonu, który jest gazem szlachetnym poprzedzającym cynk w układzie okresowym.
Analizując konfigurację elektronową, powłoka walencyjna cynku to powłoka n=4. Na tej powłoce znajdują się elektrony 4s2. Podpowłoka 3d jest już całkowicie zapełniona (3d10). To właśnie zapełnienie podpowłoki 3d ma istotny wpływ na właściwości cynku i definiuje liczbę jego elektronów walencyjnych.
Liczba elektronów walencyjnych cynku
Pomimo, że cynk należy do grupy 12 (IIB) układu okresowego, posiada **dwa** elektrony walencyjne. Te dwa elektrony znajdują się na podpowłoce 4s. Chociaż w konfiguracji elektronowej występuje również podpowłoka 3d, jest ona całkowicie wypełniona, co powoduje, że elektrony z tej podpowłoki nie są tak łatwo dostępne do tworzenia wiązań chemicznych, jak elektrony walencyjne z podpowłoki 4s.
Wiązania tworzone przez cynk, zwykle są wiązaniami jonowymi lub kowalencyjnymi. Cynk traci te dwa elektrony walencyjne, tworząc jon Zn2+, charakteryzujący się wysoką stabilnością ze względu na całkowicie wypełnioną podpowłokę 3d. Ta tendencja do tworzenia jonu o ładunku +2 jest kluczową cechą cynku.
Właściwości i zastosowania cynku wynikające z jego elektronów walencyjnych
Obecność dwóch elektronów walencyjnych w cynku determinuje jego właściwości chemiczne i znajduje odzwierciedlenie w jego zastosowaniach. Cynk jest metalem o srebrzysto-białym kolorze, stosunkowo odpornym na korozję. Dzięki temu, jest powszechnie używany do ochrony innych metali przed korozją, np. poprzez cynkowanie blachy stalowej.
Cynk jest również ważnym składnikiem wielu stopów, takich jak mosiądz (stop cynku z miedzią) i brąz (stop miedzi, cyny i innych metali, czasem również cynku). Stopy te charakteryzują się lepszymi właściwościami mechanicznymi niż czysta miedź, takie jak większa wytrzymałość i odporność na korozję.
Związki cynku mają szerokie zastosowanie. Tlenek cynku (ZnO) jest stosowany jako pigment w farbach, kremach z filtrem UV i w przemyśle gumowym. Siarczek cynku (ZnS) jest luminoforem, czyli substancją emitującą światło pod wpływem promieniowania, wykorzystywanym w ekranach telewizorów i monitorów. Chlorek cynku (ZnCl2) jest stosowany jako topnik przy lutowaniu.
Cynk jest pierwiastkiem śladowym niezbędnym do prawidłowego funkcjonowania organizmów żywych, w tym człowieka. Bierze udział w wielu procesach metabolicznych, w tym w syntezie białek, DNA i RNA, a także w funkcjonowaniu układu odpornościowego. Niedobór cynku może prowadzić do różnych problemów zdrowotnych, dlatego ważne jest, aby dbać o odpowiednią podaż tego pierwiastka w diecie.
Podsumowanie
Podsumowując, cynk posiada **dwa** elektrony walencyjne, znajdujące się na podpowłoce 4s. Ta liczba elektronów determinuje jego właściwości chemiczne i wpływa na jego liczne zastosowania w przemyśle, medycynie i biologii. Zapełniona podpowłoka 3d w atomie cynku powoduje, że pomimo przynależności do bloku d, zachowuje się on inaczej niż inne metale przejściowe, tworząc zwykle jony o ładunku +2.