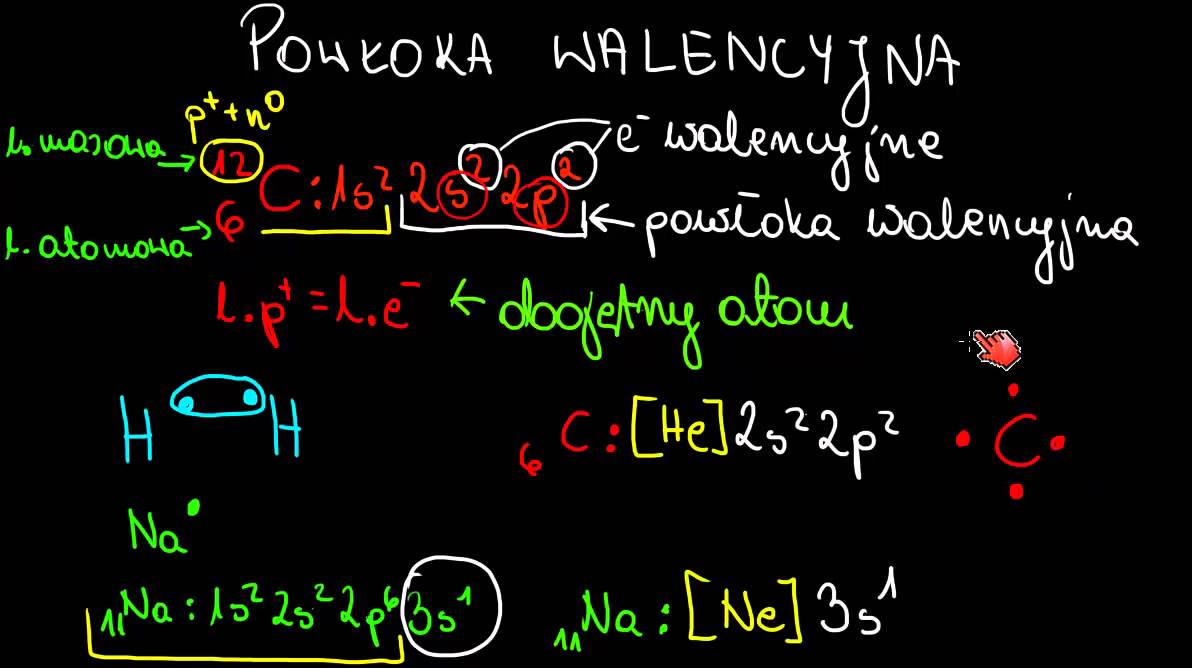Atomy są jak małe wszechświaty. Mają jądro i elektrony krążące wokół.
Powłoki Elektronowe: Orbity Atomowe
Elektrony nie krążą chaotycznie. Mają swoje ścieżki – powłoki elektronowe. Wyobraź sobie system planetarny. Planety krążą po orbitach, prawda? Podobnie jest z elektronami.
Mamy K (pierwsza), L (druga), M (trzecia) i tak dalej. To jak piętra w atomowym budynku. Każde piętro może pomieścić określoną liczbę mieszkańców (elektronów).
Maksymalna Liczba Elektronów na Powłoce
Ile elektronów zmieści się na każdej powłoce? Jest na to zasada.Powłoka K (pierwsza) jest najbliżej jądra. Jest jak małe mieszkanie. Mieści tylko 2 elektrony. Pamiętaj: tylko 2.
Powłoka L (druga) jest większa. Wyobraź sobie, że to dom jednorodzinny. Może pomieścić aż 8 elektronów. Dużo więcej niż powłoka K!
Powłoka M (trzecia) jest jeszcze większa. To jak blok mieszkalny. Zazwyczaj pomieści 18 elektronów, ale sprawa jest trochę bardziej skomplikowana. O tym za chwilę.
Istnieje wzór matematyczny: 2n2. n to numer powłoki. Na przykład, dla powłoki K (n=1) mamy 2 * 12 = 2. Dla powłoki L (n=2) mamy 2 * 22 = 8. Dla powłoki M (n=3) mamy 2 * 32 = 18.
Pamiętaj o tym wzorze! Pomaga obliczyć teoretyczną maksymalną liczbę elektronów.
Stabilność i Reguła Oktetu
Atomy dążą do stabilności. Chcą mieć pełną zewnętrzną powłokę elektronową. To jak dążenie do szczęścia. Pełna powłoka to szczęśliwy atom.
Dla większości atomów, reguła oktetu jest kluczowa. Oktet oznacza 8 elektronów. Atom, który ma 8 elektronów na swojej zewnętrznej powłoce, jest bardzo stabilny.
Wyobraź sobie neon (Ne). Ma 10 elektronów. 2 na powłoce K i 8 na powłoce L. Powłoka L jest pełna. Neon jest gazem szlachetnym. Nie lubi wchodzić w reakcje. Jest szczęśliwy sam ze sobą.
Weźmy sód (Na). Ma 11 elektronów. 2 na powłoce K, 8 na powłoce L i 1 na powłoce M. Sód jest bardzo reaktywny. Chce pozbyć się tego jednego elektronu, aby mieć pełną powłokę L.
Chlor (Cl) ma 17 elektronów. 2 na powłoce K, 8 na powłoce L i 7 na powłoce M. Chlor potrzebuje jednego elektronu, aby wypełnić powłokę M. Dlatego sód i chlor reagują ze sobą! Sód oddaje swój elektron chlorowi. Powstaje chlorek sodu – sól kuchenna (NaCl).
Wyjątki i Subpowłoki
Życie nie jest zawsze proste, prawda? Podobnie jest z atomami. Reguła oktetu ma wyjątki. Szczególnie dla większych atomów.
Powłoki dzielą się na subpowłoki. Wyobraź sobie, że piętro w budynku ma różne mieszkania: małe kawalerki, większe apartamenty i luksusowe penthouse’y. Te "mieszkania" to subpowłoki.
Mamy subpowłoki s, p, d i f. Każda subpowłoka może pomieścić inną liczbę elektronów. Subpowłoka s mieści 2 elektrony. Subpowłoka p mieści 6 elektronów. Subpowłoka d mieści 10 elektronów. Subpowłoka f mieści 14 elektronów.
To tłumaczy, dlaczego powłoka M teoretycznie może pomieścić 18 elektronów. Ale zanim dojdzie do tej liczby, atom może zacząć wypełniać powłokę N. To zależy od poziomów energetycznych subpowłok. To trochę bardziej zaawansowane zagadnienie.
Konfiguracja Elektronowa
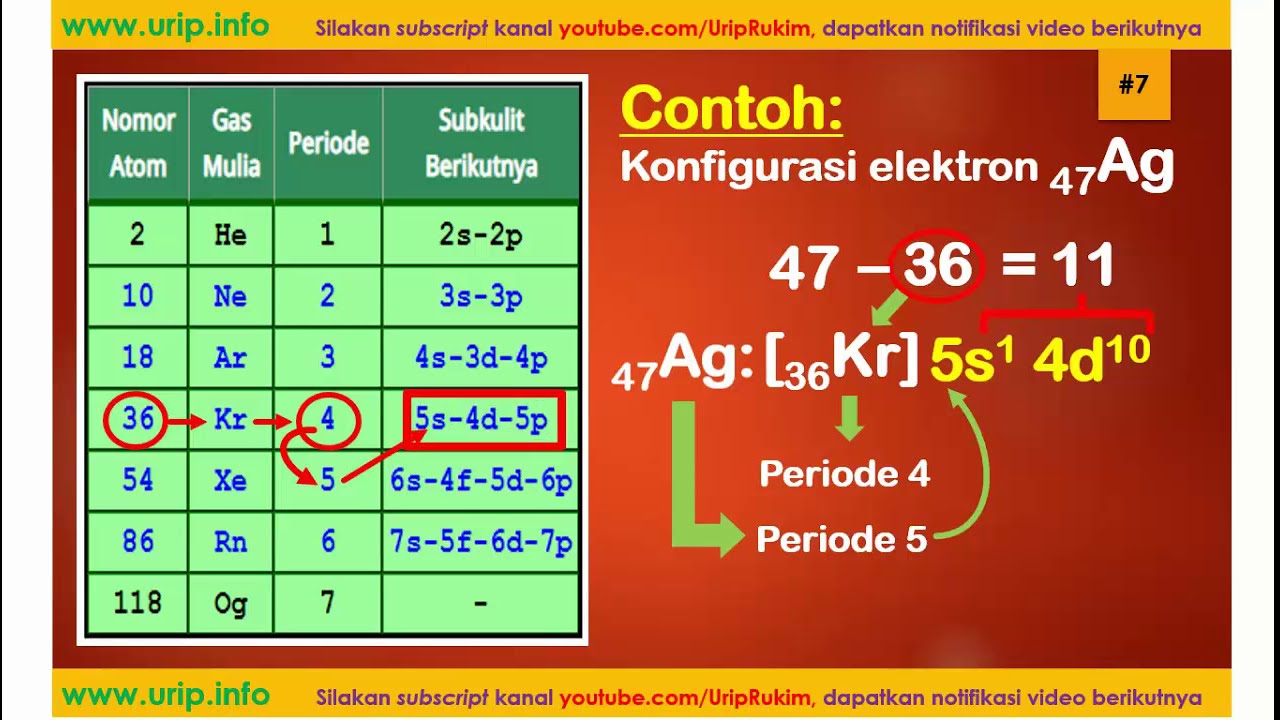
Konfiguracja elektronowa to sposób zapisywania, jak elektrony są rozmieszczone w atomie. Na przykład dla sodu (Na) konfiguracja elektronowa to 1s2 2s2 2p6 3s1. To oznacza: 2 elektrony na subpowłoce 1s, 2 elektrony na subpowłoce 2s, 6 elektronów na subpowłoce 2p i 1 elektron na subpowłoce 3s.
Analizując konfigurację elektronową, możemy przewidzieć właściwości chemiczne pierwiastka. To bardzo potężne narzędzie!
Podsumowanie
Elektrony krążą wokół jądra atomowego na powłokach. Każda powłoka ma określoną pojemność. Atomy dążą do stabilności. Często oznacza to posiadanie 8 elektronów na zewnętrznej powłoce (reguła oktetu). Powłoki dzielą się na subpowłoki. Konfiguracja elektronowa opisuje rozmieszczenie elektronów.
Zapamiętaj te koncepcje! Pomogą Ci zrozumieć chemię.