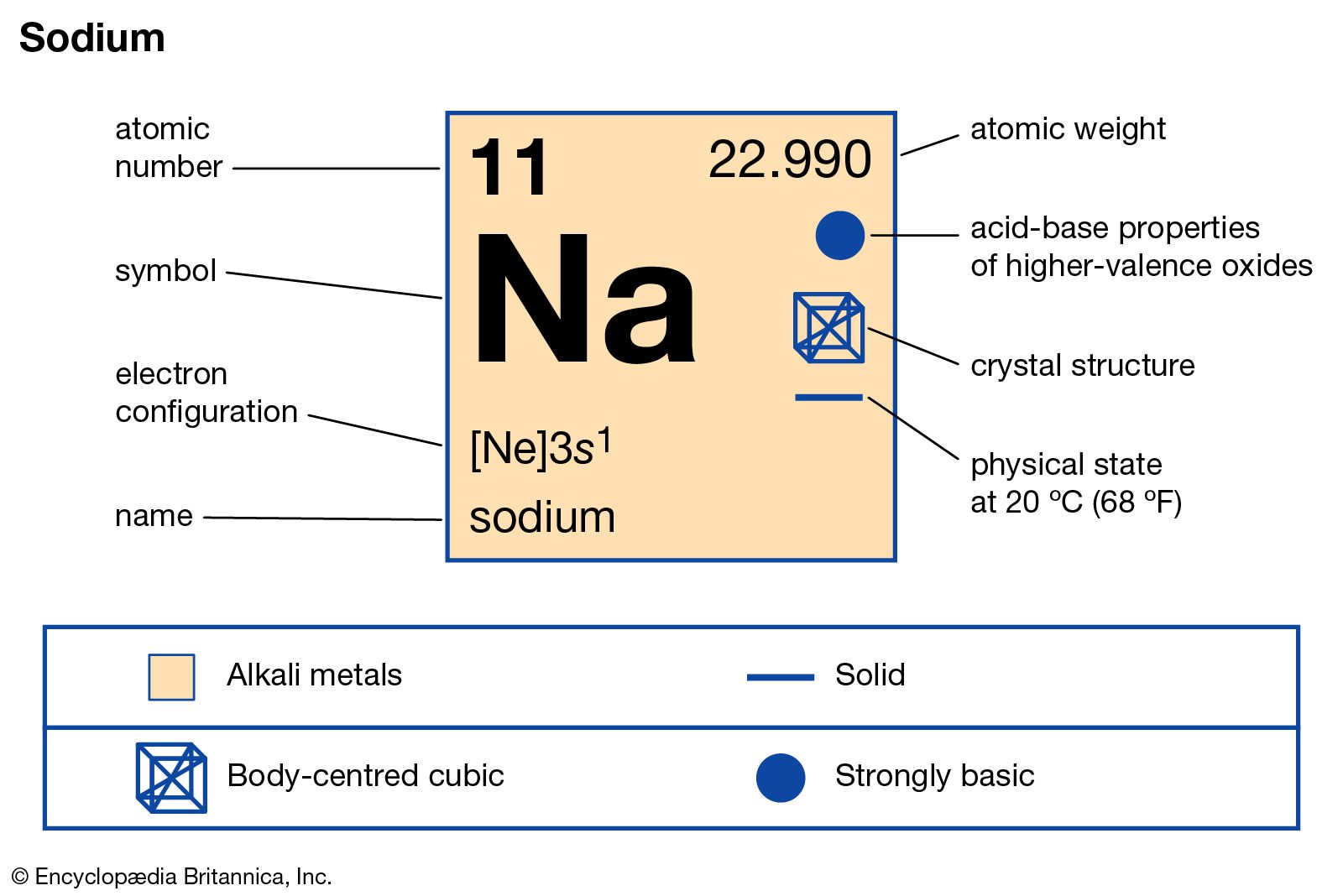
Zacznijmy od podstaw chemii. Musimy zrozumieć, czym jest wzór chemiczny i co oznacza.
Wzór chemiczny to sposób na przedstawienie składu związku chemicznego za pomocą symboli pierwiastków i liczb. Liczby te wskazują, ile atomów danego pierwiastka wchodzi w skład cząsteczki związku.
Na przykład, wzór NaCl reprezentuje chlorek sodu, czyli sól kuchenną. Składa się on z jednego atomu sodu (Na) i jednego atomu chloru (Cl). Oznacza to, że na jedną cząsteczkę NaCl przypada jeden atom Na i jeden atom Cl.
Pojęcie Mola
Teraz przejdźmy do pojęcia mola. Mol to jednostka ilości materii, która zawiera dokładnie 6.022 x 1023 jednostek elementarnych (atomów, cząsteczek, jonów itp.). Ta liczba to liczba Avogadro, często oznaczana jako NA.
Mol to bardzo przydatne pojęcie, ponieważ pozwala nam przeliczać masę substancji na liczbę cząsteczek i odwrotnie. Wyobraź sobie, że masz paczkę cukierków. Wiedząc, że każda paczka zawiera 20 cukierków, możesz łatwo obliczyć, ile cukierków masz, mając 5 paczek. Mol działa na podobnej zasadzie, tylko w skali atomowej.
Jeden mol dowolnej substancji zawiera liczbę Avogadro cząsteczek tej substancji. Na przykład, jeden mol wody (H2O) zawiera 6.022 x 1023 cząsteczek wody.
Obliczanie ilości Sodu w 6 molach NaCl
Pytanie, które musimy rozwiązać, to: ile atomów sodu (Na) znajduje się w 6 molach chlorku sodu (NaCl)?
Wiemy już, że jeden mol NaCl zawiera 6.022 x 1023 cząsteczek NaCl. Znamy także wzór chemiczny NaCl, który mówi nam, że w każdej cząsteczce NaCl znajduje się jeden atom Na.
Zatem, w jednym molu NaCl znajduje się 6.022 x 1023 atomów Na. Logiczne, prawda? Ponieważ każda cząsteczka NaCl ma tylko jeden atom Na.
Aby obliczyć ilość atomów Na w 6 molach NaCl, musimy pomnożyć liczbę atomów Na w jednym molu NaCl przez 6. Działanie wygląda następująco:
6 moli NaCl * (6.022 x 1023 atomów Na / 1 mol NaCl) = 36.132 x 1023 atomów Na
Możemy to zapisać bardziej poprawnie w notacji naukowej: 3.6132 x 1024 atomów Na.
Oznacza to, że w 6 molach chlorku sodu (NaCl) znajduje się 3.6132 x 1024 atomów sodu (Na).
Podsumowanie
Podsumowując, aby obliczyć ilość atomów danego pierwiastka w określonej liczbie moli związku chemicznego, należy:
- Określić wzór chemiczny związku.
- Zidentyfikować, ile atomów interesującego nas pierwiastka znajduje się w jednej cząsteczce związku.
- Pomnożyć liczbę moli związku przez liczbę Avogadro (6.022 x 1023).
- Pomnożyć wynik przez liczbę atomów pierwiastka w jednej cząsteczce związku.
Pamiętaj, że to pojęcie jest fundamentalne w chemii i przydaje się w wielu obliczeniach stechiometrycznych, na przykład przy ustalaniu ilości reagentów potrzebnych do przeprowadzenia reakcji chemicznej.
Przykład praktyczny
Wyobraź sobie, że prowadzisz eksperyment w laboratorium i potrzebujesz dokładnie odmierzyć ilość sodu (Na) do reakcji. Mając 6 moli chlorku sodu (NaCl), wiesz, że dysponujesz 3.6132 x 1024 atomami Na. Możesz teraz przeliczyć to na masę sodu i odważyć odpowiednią ilość NaCl, aby uzyskać pożądaną masę sodu.
Rozumienie tych zależności jest kluczowe dla precyzyjnego prowadzenia eksperymentów i obliczeń chemicznych.