Cześć! Zastanawiasz się, jak odnaleźć się w świecie układu okresowego pierwiastków? To wcale nie jest takie trudne, jak mogłoby się wydawać. Spróbujmy to zrozumieć krok po kroku. Dowiesz się, czym są okresy i grupy, i gdzie ich szukać na tej magicznej tablicy.
Czym w ogóle jest układ okresowy?
Wyobraź sobie, że masz ogromną bibliotekę, a w niej mnóstwo książek. Układ okresowy to taka biblioteka dla wszystkich znanych nam pierwiastków chemicznych. Każdy pierwiastek ma swoje "miejsce" w tej bibliotece, określone przez jego właściwości. To uporządkowany sposób przedstawiania pierwiastków, ułatwiający zrozumienie ich podobieństw i różnic. Myśl o tym jak o mapie skarbów chemii!
Układ okresowy, zwany też tablicą Mendelejewa, to graficzne przedstawienie wszystkich znanych pierwiastków. Został on ułożony tak, aby pierwiastki o podobnych właściwościach znajdowały się blisko siebie. Umożliwia to przewidywanie zachowań i reakcji chemicznych różnych substancji.
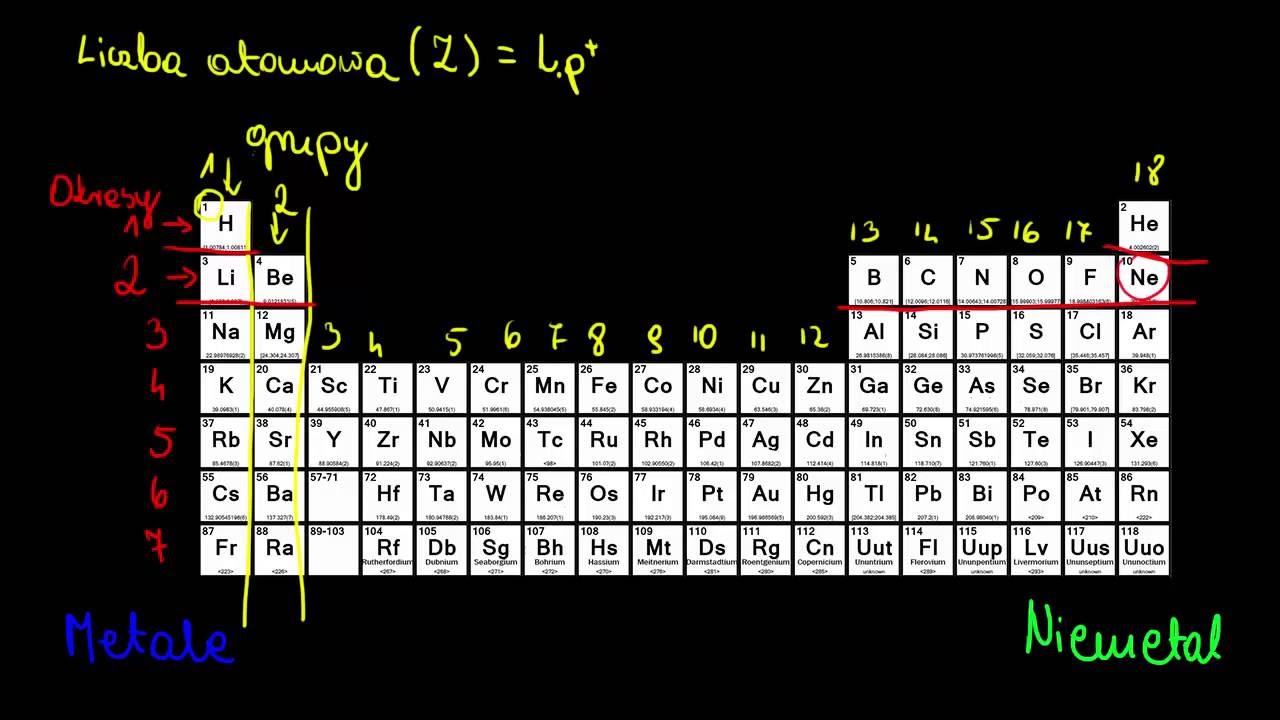
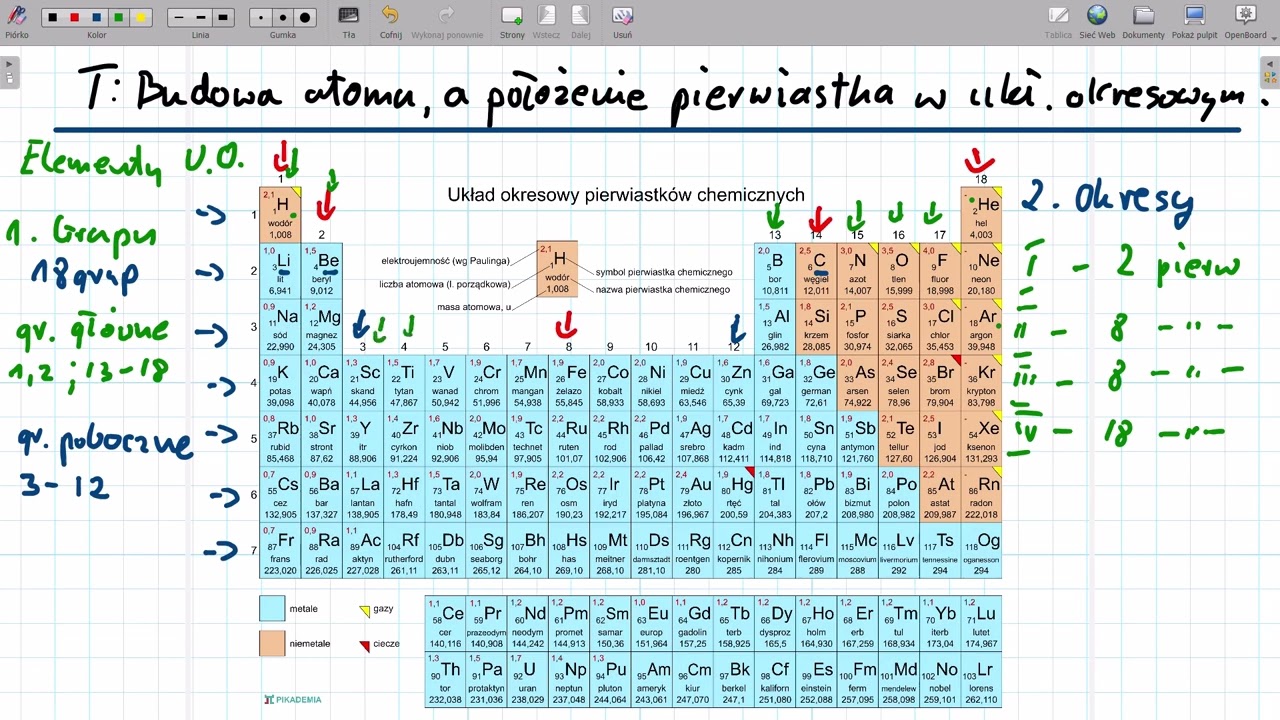
Okresy: Poziome rzędy w układzie okresowym
Okres to poziomy rząd pierwiastków w układzie okresowym. Wyobraź sobie rząd krzeseł w kinie. Każdy rząd to jeden okres. Czytamy je od lewej do prawej. Okresy numerowane są liczbami od 1 do 7, choć niektóre układają się jakby w dwóch rzędach u dołu tablicy.
Każdy okres zaczyna się od pierwiastka o bardzo silnych właściwościach metalicznych, a kończy się pierwiastkiem o silnych właściwościach niemetalicznych (z wyjątkiem pierwszego okresu, który kończy się helem, gazem szlachetnym). W obrębie okresu, wraz ze wzrostem liczby atomowej, zmieniają się właściwości pierwiastków. To jakby obserwować ewolucję – od metalu, przez metaloidy, aż po niemetal.
Na przykład, w 3 okresie znajdziemy sód (Na), który jest bardzo aktywnym metalem. Dalej jest magnez (Mg), potem glin (Al), który ma już pewne właściwości niemetaliczne. Następnie mamy krzem (Si), który jest metaloidem, a potem fosfor (P), siarkę (S) i chlor (Cl), które są niemetalami. Na końcu jest argon (Ar), gaz szlachetny. Widzimy więc wyraźną zmianę właściwości wzdłuż okresu.
Grupy: Pionowe kolumny w układzie okresowym
Grupa to pionowa kolumna pierwiastków w układzie okresowym. To tak jakby ustawić ludzi jeden za drugim w kolejce. Czytamy je od góry do dołu. Grupy są numerowane od 1 do 18. Pierwiastki w tej samej grupie mają podobne właściwości chemiczne.
Dzieje się tak, ponieważ pierwiastki w tej samej grupie mają taką samą liczbę elektronów walencyjnych. To elektrony na najbardziej zewnętrznej powłoce atomu, które decydują o tym, jak pierwiastek reaguje z innymi pierwiastkami. Wyobraź sobie, że elektrony walencyjne to takie ręce, którymi pierwiastek "chwyta" inne pierwiastki, tworząc związki chemiczne.
Przykład: weźmy grupę 1, czyli metale alkaliczne (lit, sód, potas, rubid, cez, frans). Wszystkie te metale reagują bardzo gwałtownie z wodą. Wrzuć kawałek sodu do wody, a zobaczysz, że zacznie się palić i eksplodować! Dzieje się tak, ponieważ mają one tylko jeden elektron walencyjny, który bardzo łatwo oddają.
Jak znaleźć okres i grupę?
Aby znaleźć okres, po prostu szukasz numeru poziomego rzędu, w którym znajduje się dany pierwiastek. Aby znaleźć grupę, szukasz numeru pionowej kolumny. Spójrz na układ okresowy. Znajdź tlen (O). W jakim jest okresie? Jest w okresie 2. W jakiej jest grupie? Jest w grupie 16. Proste, prawda?
Warto zapamiętać, że niektóre grupy mają swoje własne nazwy. Na przykład, grupa 1 to metale alkaliczne, grupa 2 to metale ziem alkalicznych, grupa 17 to halogeny, a grupa 18 to gazy szlachetne. Znajomość tych nazw ułatwi Ci poruszanie się po układzie okresowym. To jak znać nazwy głównych ulic w mieście.
Wyjątki i niuanse
Układ okresowy ma pewne wyjątki. Lantanowce i aktynowce, czyli te dwa rzędy na dole układu, formalnie należą do okresów 6 i 7, ale są wyodrębnione, aby tablica była bardziej czytelna. Podobnie wodór (H), choć znajduje się w grupie 1, ma unikalne właściwości i nie do końca pasuje do metali alkalicznych. Zawsze jest trochę "inny" w tym towarzystwie.
Pamiętaj też, że właściwości pierwiastków w obrębie grupy mogą się różnić. Na przykład, lit (Li), choć jest metalem alkalicznym, reaguje z wodą mniej gwałtownie niż sód (Na). Im dalej w dół grupy, tym reaktywność zazwyczaj wzrasta. To jak z rodzeństwem – choć mają wspólnych rodziców, każdy ma swój charakter.
Podsumowanie
Mam nadzieję, że teraz lepiej rozumiesz, czym są okresy i grupy w układzie okresowym. Pamiętaj: okres to poziomy rząd, a grupa to pionowa kolumna. Pierwiastki w tej samej grupie mają podobne właściwości chemiczne, a właściwości pierwiastków w obrębie okresu zmieniają się stopniowo. Wykorzystaj tę wiedzę, aby odkrywać fascynujący świat chemii!
Układ okresowy to niezwykle potężne narzędzie, które pozwala nam przewidywać i rozumieć zachowania pierwiastków. To jak mapa wszechświata chemicznego. Im lepiej ją poznasz, tym łatwiej będzie Ci się po nim poruszać i odkrywać nowe rzeczy. Powodzenia w dalszej nauce!