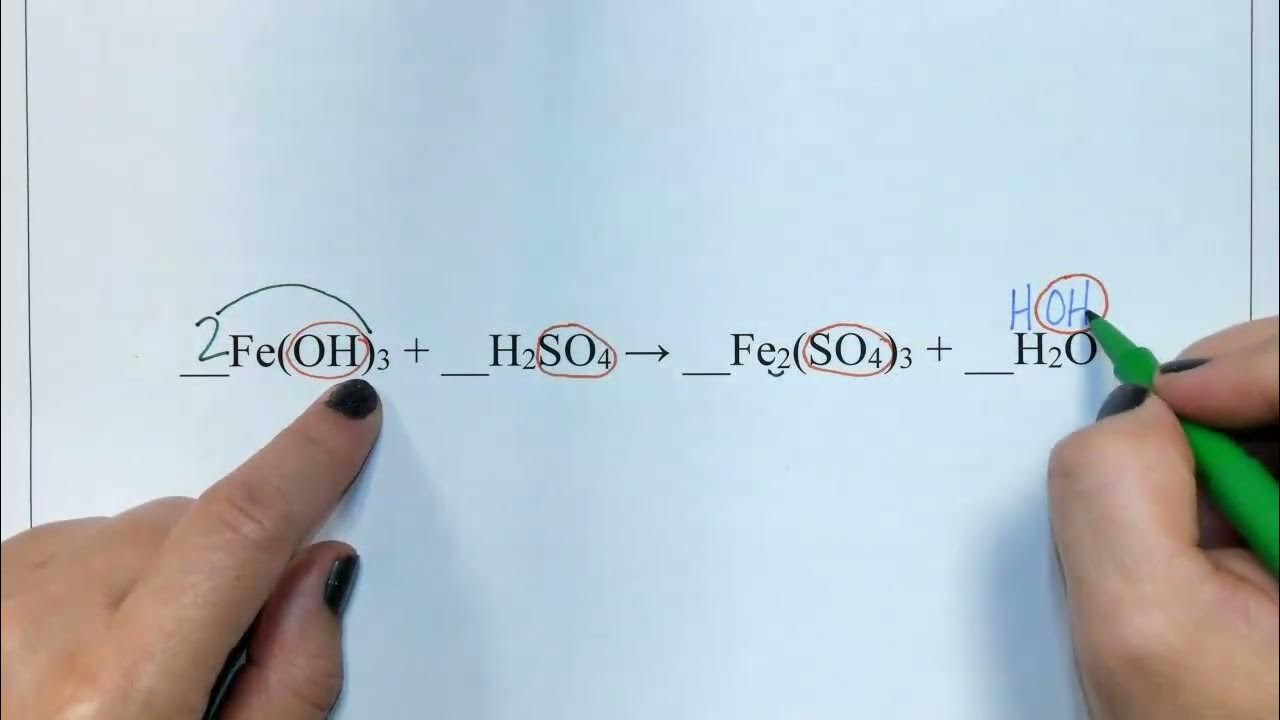Równanie chemiczne Fe Oh 3 H2so4 Fe2 So4 3 H2o wymaga zbilansowania. Jest to istotne zagadnienie w chemii.
Wprowadzenie do bilansowania równań chemicznych
Bilansowanie równań chemicznych jest fundamentalną umiejętnością. Umożliwia zrozumienie ilościowych relacji między reagentami i produktami. Ważne jest, aby uczniowie opanowali tę umiejętność. Jest to niezbędne do dalszej nauki chemii.
Dlaczego bilansujemy równania?
Bilansowanie równań wynika z prawa zachowania masy. Prawo to mówi, że masa nie może być tworzona ani niszczona. W związku z tym, liczba atomów każdego pierwiastka musi być taka sama po obu stronach równania. Brak zbilansowania to brak zgodności z podstawowymi zasadami chemii.
Równanie Fe Oh 3 H2so4 Fe2 So4 3 H2o przedstawia reakcję między wodorotlenkiem żelaza(III) i kwasem siarkowym. Produktami są siarczan żelaza(III) i woda. Musimy zapewnić, że liczba atomów żelaza, tlenu, wodoru i siarki jest równa po obu stronach równania.
Krok po kroku: Bilansowanie Fe Oh 3 H2so4 Fe2 So4 3 H2o
Przedstawiamy metodę krok po kroku. Jest to proces iteracyjny, wymagający cierpliwości i systematyczności. Zacznijmy bilansować nasze równanie.
Krok 1: Zapisanie niezbilansowanego równania
Zaczynamy od: Fe(OH)3 + H2SO4 → Fe2(SO4)3 + H2O.
Krok 2: Bilansowanie żelaza (Fe)
Po lewej stronie mamy 1 atom żelaza, a po prawej 2. Zatem dodajemy współczynnik 2 przed Fe(OH)3: 2Fe(OH)3 + H2SO4 → Fe2(SO4)3 + H2O. Teraz żelazo jest zbilansowane.
Krok 3: Bilansowanie siarki (S)
Po lewej stronie mamy 1 atom siarki, a po prawej 3. Dodajemy współczynnik 3 przed H2SO4: 2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + H2O. Siarka jest teraz zbilansowana.
Krok 4: Bilansowanie wodoru (H)
Po lewej stronie mamy 2 * 3 (z Fe(OH)3) + 3 * 2 (z H2SO4) = 6 + 6 = 12 atomów wodoru. Po prawej stronie mamy 2 atomy wodoru w H2O. Dodajemy współczynnik 6 przed H2O: 2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O.
Krok 5: Bilansowanie tlenu (O)
Po lewej stronie mamy 2 * 3 (z Fe(OH)3) + 3 * 4 (z H2SO4) = 6 + 12 = 18 atomów tlenu. Po prawej stronie mamy 3 * 4 (z Fe2(SO4)3) + 6 * 1 (z H2O) = 12 + 6 = 18 atomów tlenu. Tlen jest zbilansowany.
Krok 6: Sprawdzenie zbilansowanego równania
Upewniamy się, że wszystkie atomy są zbilansowane. Ostateczne zbilansowane równanie to: 2Fe(OH)3 + 3H2SO4 → Fe2(SO4)3 + 6H2O.
Wskazówki dla nauczycieli
Wyjaśnianie bilansowania równań chemicznych może być wyzwaniem. Kluczem jest prostota i stopniowe wprowadzanie trudności. Należy wykorzystywać wizualizacje i analogie.
Wizualizacje
Używaj modeli atomów lub rysunków, aby pokazać, jak atomy przemieszczają się. To pomaga uczniom zrozumieć, że atomy nie znikają. Po prostu zmieniają swoje połączenia.
Analogia
Porównaj bilansowanie równań do bilansowania wagi. Po obu stronach wagi musi być taka sama masa. Podobnie, po obu stronach równania musi być taka sama liczba atomów każdego pierwiastka. To upraszcza koncepcję.
Przykłady
Rozpocznij od prostych przykładów, takich jak H2 + O2 → H2O. Następnie przejdź do bardziej złożonych, takich jak Fe Oh 3 H2so4 Fe2 So4 3 H2o. Stopniowe zwiększanie trudności jest skuteczne.
Gry i interakcje
Wykorzystuj gry online lub interaktywne symulacje. Uczniowie mogą eksperymentować z różnymi współczynnikami. To sprawia, że nauka jest bardziej angażująca. Jest to forma zabawy, która utrwala wiedzę.
Typowe błędy i jak ich unikać
Uczniowie często popełniają pewne błędy. Ważne jest, aby być świadomym tych błędów. Pozwala to na skuteczne reagowanie i wyjaśnianie.
Zmiana indeksów
Najczęstszym błędem jest zmiana indeksów w związkach chemicznych. Należy przypomnieć, że zmieniamy tylko współczynniki przed związkami. Zmiana indeksów zmienia sam związek. np. H2O to co innego niż H2O2.
Niedokładne liczenie atomów
Upewnij się, że uczniowie dokładnie liczą atomy po obu stronach równania. Szczególnie w przypadku związków z nawiasami. Pokaż jak poprawnie mnożyć współczynniki i indeksy.
Brak systematyczności
Uczniowie powinni pracować systematycznie. Bilansowanie krok po kroku, sprawdzanie każdego pierwiastka. Pośpiech prowadzi do błędów. Wypracuj nawyk dokładności.
Jak uczynić bilansowanie równań bardziej interesującym?
Bilansowanie równań może wydawać się nudne. Istnieją sposoby na uczynienie go bardziej interesującym i angażującym.
Kontekst życiowy
Pokaż, jak bilansowanie równań jest używane w życiu codziennym. Na przykład, w procesach przemysłowych lub w badaniach naukowych. To zwiększa motywację.
Zadania problemowe
Daj uczniom zadania problemowe, które wymagają bilansowania równań. Na przykład, obliczenie ilości reagentów potrzebnych do otrzymania określonej ilości produktu. Praktyczne zastosowanie utrwala wiedzę.
Rywalizacja
Organizuj konkursy bilansowania równań. Uczniowie mogą rywalizować indywidualnie lub w grupach. Zdrowa rywalizacja pobudza do nauki.
Podsumowanie
Bilansowanie równania Fe Oh 3 H2so4 Fe2 So4 3 H2o jest doskonałym przykładem do nauki. Wykorzystaj przedstawione wskazówki. Uczniowie zdobędą solidne podstawy chemii. Ważne jest cierpliwe i systematyczne podejście.