Drodzy nauczyciele chemii!
Przygotowałem dla Was materiał, który pomoże w wyjaśnieniu tematu jonów obecnych w roztworze K2CO3 (węglanu potasu).
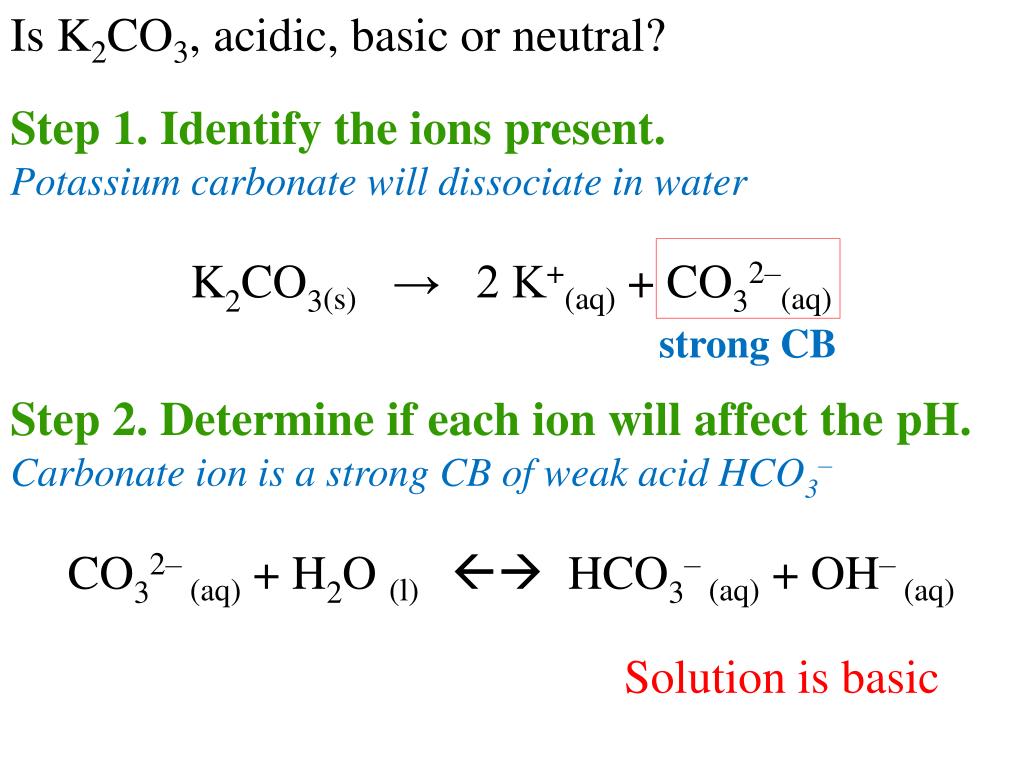
Analiza roztworu K2CO3
Rozważmy, co dzieje się, gdy K2CO3 jest rozpuszczany w wodzie. K2CO3 to związek jonowy. Zatem dysocjuje w wodzie.
Proces dysocjacji jonowej polega na rozpadzie związku na jony. K2CO3 rozpada się na jony potasu (K+) i jony węglanowe (CO32-).
Równanie dysocjacji
Równanie reakcji dysocjacji wygląda następująco: K2CO3 (s) → 2K+ (aq) + CO32- (aq). (s) oznacza stan stały, a (aq) oznacza, że jony są uwodnione.
Jony w roztworze
W roztworze obecne są jony potasu (K+) i jony węglanowe (CO32-). Liczba jonów potasu jest dwukrotnie większa niż jonów węglanowych. Wynika to ze stechiometrii równania dysocjacji. Każda cząsteczka K2CO3 daje dwa jony K+ i jeden jon CO32-.
Wskazówki dla nauczycieli
Wyjaśnij, czym jest związek jonowy. Podkreśl, że związki jonowe w roztworach wodnych dysocjują na jony. Użyj prostych przykładów, takich jak NaCl, zanim przejdziesz do K2CO3.
Zastosuj wizualizacje. Narysuj na tablicy proces dysocjacji jonowej. Możesz użyć kolorowych kółek, aby przedstawić jony potasu i węglanowe.
Użyj modelu. Możesz użyć modelu krystalicznego K2CO3, a następnie pokazać, jak rozpada się on na jony w wodzie. Pokazuj, jak cząsteczki wody otaczają i stabilizują jony.
Typowe nieporozumienia
Uczniowie mogą myśleć, że K2CO3 rozpada się na K2+ i CO32-. Wyjaśnij, że potas zawsze występuje jako jon K+.
Uczniowie mogą myśleć, że jony znikają. Wyjaśnij, że jony pozostają w roztworze. Jony poruszają się swobodnie. Uwodnienie (otaczanie przez cząsteczki wody) stabilizuje jony.
Uczniowie mogą myśleć, że cały związek dysocjuje od razu. W rzeczywistości dysocjacja to proces dynamiczny. Istnieje równowaga między związanymi i zdysocjowanymi jonami.
Angażujące metody nauczania
Przeprowadź eksperyment. Rozpuść K2CO3 w wodzie. Sprawdź przewodnictwo elektryczne roztworu. Wyższe przewodnictwo wskazuje na obecność jonów.
Zadaj pytanie problemowe. Co się stanie, gdy dodamy kwas do roztworu K2CO3? To prowadzi do omówienia reakcji kwasowo-zasadowych i powstawania gazowego CO2.
Stwórz grę. Stwórz grę, w której uczniowie dopasowują związki jonowe do ich jonów składowych. To wzmacnia ich zrozumienie dysocjacji jonowej.
Hydroliza jonu węglanowego
Jon węglanowy (CO32-) ulega hydrolizie. Hydroliza to reakcja jonu z wodą. W przypadku CO32-, reakcja z wodą prowadzi do powstania jonów wodorotlenkowych (OH-) i wodorowęglanowych (HCO3-). To sprawia, że roztwór K2CO3 ma odczyn zasadowy.
Równanie hydrolizy: CO32- (aq) + H2O (l) ⇌ HCO3- (aq) + OH- (aq). Zauważ, że jest to reakcja odwracalna, oznaczona przez znak równowagi ⇌.
Dodatkowo, jon wodorowęglanowy (HCO3-) również ulega hydrolizie, choć w mniejszym stopniu: HCO3- (aq) + H2O (l) ⇌ H2CO3 (aq) + OH- (aq). H2CO3 to kwas węglowy.
Podsumowanie jonów w roztworze K2CO3
W roztworze K2CO3 obecne są następujące jony: jony potasu (K+), jony węglanowe (CO32-), jony wodorowęglanowe (HCO3-), jony wodorotlenkowe (OH-) i jony hydroniowe (H3O+) w niewielkim stężeniu, wynikające z autoionizacji wody. Stężenie OH- jest większe niż H3O+, co nadaje roztworowi charakter zasadowy.
Wpływ na pH
Hydroliza jonu węglanowego powoduje wzrost pH roztworu. Roztwór K2CO3 będzie miał pH większe niż 7. Im wyższe stężenie K2CO3, tym wyższe będzie pH.
Podkreśl, że hydroliza jest ważnym procesem. Hydroliza wpływa na właściwości roztworów wielu soli.
Dodatkowe wskazówki
Zachęć uczniów do zadawania pytań. Stwórz środowisko, w którym czują się swobodnie. Dzięki temu będą mogli zgłębiać swoje zrozumienie.
Powtarzaj kluczowe pojęcia. Utrwalenie wiedzy jest bardzo istotne. Powtarzaj kluczowe pojęcia, aby upewnić się, że uczniowie je rozumieją.
Powodzenia w nauczaniu!