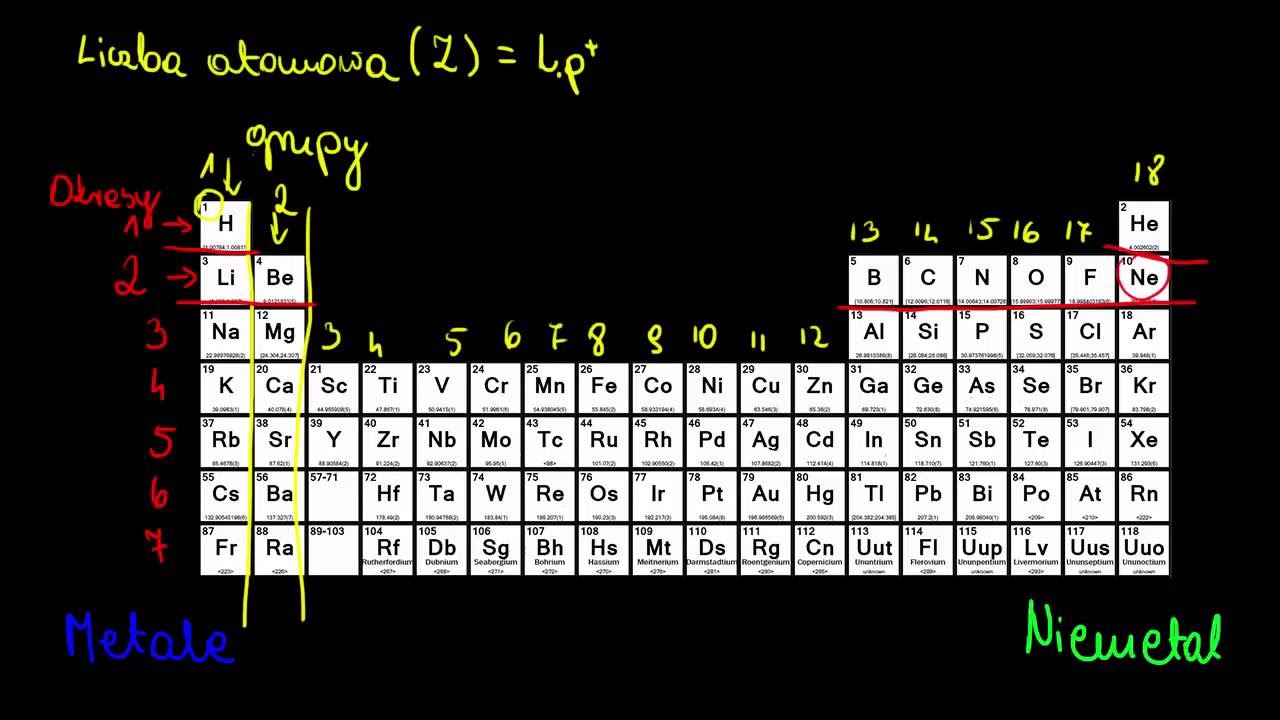
Hej Studencie! Przygotowujesz się do egzaminu z chemii? Super! Omówimy teraz elektrony walencyjne w grupach 3-12. Dasz radę! Zaczynamy!
Czym są Elektrony Walencyjne?
Elektrony walencyjne to elektrony znajdujące się na najbardziej zewnętrznej powłoce elektronowej atomu. To one decydują o właściwościach chemicznych pierwiastka.
Zapamiętaj! Liczba elektronów walencyjnych wpływa na to, jak atom będzie łączył się z innymi atomami, tworząc wiązania chemiczne.
Elektrony Walencyjne w Grupie 3
Grupa 3 to skandowce. Znajdziemy tam skand (Sc), itr (Y), lantan (La) i aktyn (Ac). Także lantanowce i aktynowce formalnie należą do tej grupy.
Typowo, pierwiastki te posiadają 3 elektrony walencyjne. Konfiguracja elektronowa zewnętrznej powłoki to zazwyczaj ns2(n-1)d1.
Przykład: Skand (Sc) ma konfigurację [Ar] 3d14s2. Czyli ma 3 elektrony walencyjne.
Pamiętaj! Lantanowce i aktynowce mają bardziej skomplikowaną konfigurację, ale także dążą do oddania 3 elektronów.
Elektrony Walencyjne w Grupie 4
Grupa 4 to tytanowce. Należą do niej tytan (Ti), cyrkon (Zr), hafn (Hf) i rutherford (Rf).
Mają zazwyczaj 4 elektrony walencyjne. Ich konfiguracja elektronowa to ns2(n-1)d2.
Przykład: Tytan (Ti) ma konfigurację [Ar] 3d24s2. Czyli ma 4 elektrony walencyjne.
Elektrony Walencyjne w Grupie 5
Grupa 5 zawiera pierwiastki takie jak wanad (V), niob (Nb), tantal (Ta) i dubn (Db). Są to wanadowce.
Posiadają 5 elektronów walencyjnych. Konfiguracja to ns2(n-1)d3.
Przykład: Wanad (V) ma konfigurację [Ar] 3d34s2. To 5 elektronów walencyjnych.
Elektrony Walencyjne w Grupie 6
Do grupy 6 należą chromowce: chrom (Cr), molibden (Mo), wolfram (W) i seaborg (Sg).
Tutaj pojawiają się wyjątki! Chrom (Cr) ma konfigurację [Ar] 3d54s1, a molibden (Mo) [Kr] 4d55s1. Zazwyczaj dążą do posiadania 6 elektronów walencyjnych, ale konfiguracja bywa niestandardowa ze względu na stabilność podpowłok d.
Warto zapamiętać ten wyjątek! Chrom i molibden mają nietypowe konfiguracje elektronowe.
Elektrony Walencyjne w Grupie 7
Grupa 7 to manganowce. Mamy tutaj mangan (Mn), technet (Tc), ren (Re) i bohr (Bh).
Typowo, mają 7 elektronów walencyjnych. Konfiguracja to ns2(n-1)d5.
Przykład: Mangan (Mn) ma konfigurację [Ar] 3d54s2. Czyli 7 elektronów walencyjnych.
Elektrony Walencyjne w Grupie 8
Grupa 8 to żelazowce: żelazo (Fe), ruten (Ru), osm (Os) i has (Hs).
Zazwyczaj mają 8 elektronów walencyjnych. Konfiguracja to ns2(n-1)d6.
Przykład: Żelazo (Fe) ma konfigurację [Ar] 3d64s2. To 8 elektronów walencyjnych.
Elektrony Walencyjne w Grupie 9
Do grupy 9 należą kobaltowce: kobalt (Co), rod (Rh), iryd (Ir) i meitner (Mt).
Mają 9 elektronów walencyjnych. Konfiguracja to ns2(n-1)d7.
Przykład: Kobalt (Co) ma konfigurację [Ar] 3d74s2. Czyli 9 elektronów walencyjnych.
Elektrony Walencyjne w Grupie 10
Grupa 10 to nikielowce: nikiel (Ni), pallad (Pd), platyna (Pt) i darmsztadt (Ds).
Podobnie jak chrom, pallad jest wyjątkiem. Dążą do 10 elektronów walencyjnych. Konfiguracja to ns2(n-1)d8. Pallad (Pd) ma konfigurację [Kr] 4d10.
Pamiętaj o wyjątku! Pallad ma specyficzną konfigurację elektronową.
Elektrony Walencyjne w Grupie 11
Grupa 11, to miedziowce: miedź (Cu), srebro (Ag), złoto (Au) i roentgen (Rg).
Kolejne wyjątki! Miedź (Cu) i srebro (Ag), podobnie jak chrom, mają nietypowe konfiguracje. Dążą do 11 elektronów walencyjnych. Konfiguracja to ns1(n-1)d10.
Przykład: Miedź (Cu) ma konfigurację [Ar] 3d104s1. Mimo jednego elektronu na powłoce s, ma charakterystyczne właściwości dla tej grupy.
Elektrony Walencyjne w Grupie 12
Grupa 12 to cynkowce: cynk (Zn), kadm (Cd), rtęć (Hg) i kopernik (Cn).
Posiadają 12 elektronów walencyjnych. Konfiguracja to ns2(n-1)d10.
Przykład: Cynk (Zn) ma konfigurację [Ar] 3d104s2. Czyli ma 12 elektronów walencyjnych.
Podsumowanie
Kluczowe Punkty:
- Elektrony walencyjne to elektrony na zewnętrznej powłoce.
- Liczba elektronów walencyjnych wpływa na właściwości chemiczne.
- Grupa 3 ma zazwyczaj 3 elektrony walencyjne.
- Grupa 4 ma zazwyczaj 4 elektrony walencyjne.
- Grupa 5 ma zazwyczaj 5 elektronów walencyjne.
- Grupa 6 ma zazwyczaj 6 elektronów walencyjnych (Chrom i Molibden to wyjątki).
- Grupa 7 ma zazwyczaj 7 elektronów walencyjnych.
- Grupa 8 ma zazwyczaj 8 elektronów walencyjnych.
- Grupa 9 ma zazwyczaj 9 elektronów walencyjnych.
- Grupa 10 ma zazwyczaj 10 elektronów walencyjnych (Pallad to wyjątek).
- Grupa 11 ma zazwyczaj 11 elektronów walencyjnych (Miedź i Srebro to wyjątki).
- Grupa 12 ma zazwyczaj 12 elektronów walencyjnych.
Pamiętaj o wyjątkach! Chrom, Molibden, Miedź, Srebro i Pallad mają nietypowe konfiguracje elektronowe.
Powodzenia na egzaminie! Wierzę w Ciebie! Zapamiętaj te informacje, a na pewno dasz radę! Ucz się systematycznie i nie stresuj się! Trzymam kciuki!