Witajcie, drodzy nauczyciele! Dzisiaj skupimy się na dysocjacji jonowej kwasu azotowego(V), temacie, który może wydawać się skomplikowany, ale da się go wytłumaczyć w przystępny sposób.
Kwas Azotowy(V) - Wprowadzenie
Kwas azotowy(V), o wzorze HNO3, to jeden z najważniejszych kwasów w chemii. Jest silnym utleniaczem i mocnym kwasem. Jego właściwości wynikają z jego budowy i zdolności do dysocjacji w roztworach wodnych. Warto o tym przypomnieć uczniom na początku lekcji.
Wyjaśnienie Dysocjacji Jonowej
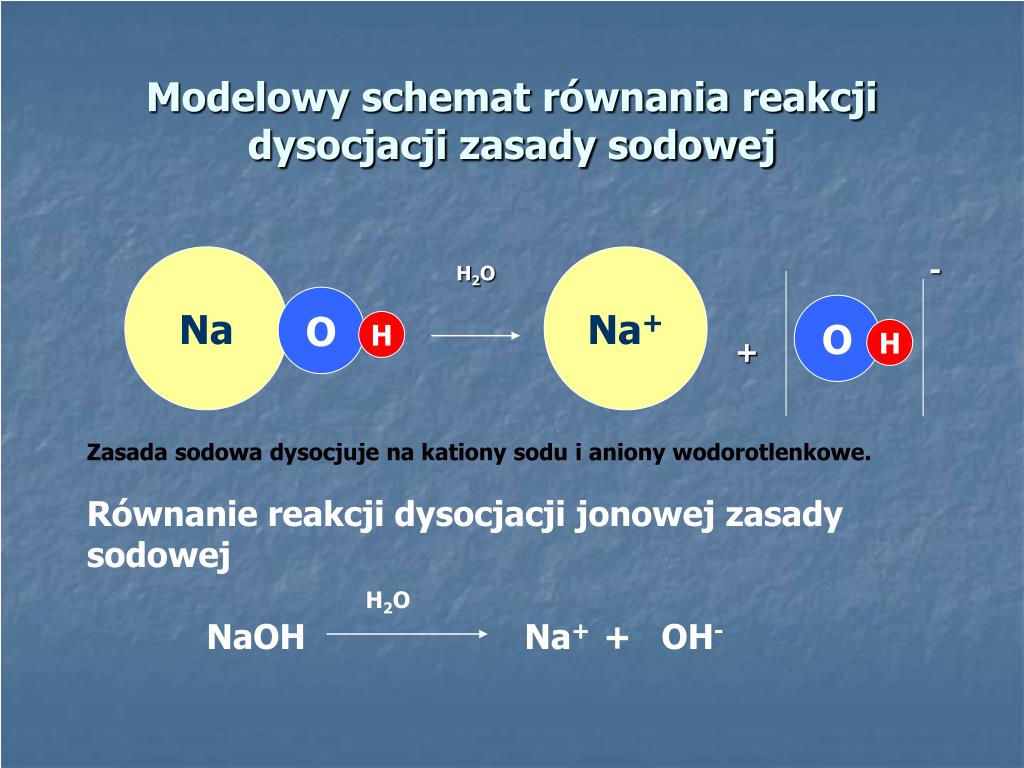
Dysocjacja jonowa to rozpad związku chemicznego na jony pod wpływem rozpuszczalnika, najczęściej wody. W przypadku HNO3, proces ten prowadzi do powstania jonów hydroniowych (H3O+) i azotanowych(V) (NO3-). Pamiętaj, aby podkreślić, że w czystym kwasie azotowym(V) dysocjacja zachodzi w niewielkim stopniu. Dopiero obecność wody znacznie ją nasila.
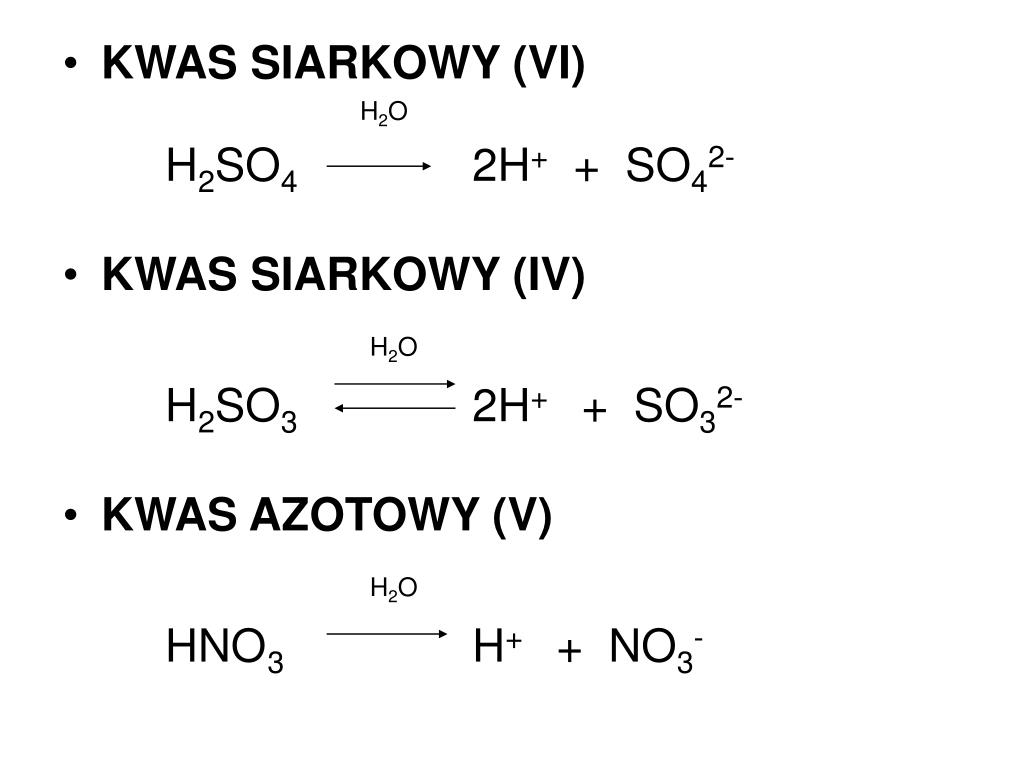
Uczniowie często mają problem z zapisywaniem równań dysocjacji. Poprawny zapis dysocjacji kwasu azotowego(V) wygląda następująco: HNO3 + H2O → H3O+ + NO3-. Można to również zapisać uproszczonym zapisem: HNO3 → H+ + NO3-, jednak warto zaznaczyć, że jony H+ natychmiast przyłączają się do cząsteczek wody tworząc jony hydroniowe.
Jak Uczyć o Dysocjacji Jonowej?
Zacznij od przypomnienia koncepcji kwasów i zasad. Można wspomnieć o teorii Arrheniusa, która definiuje kwasy jako substancje, które dysocjują w wodzie, tworząc jony H+, a zasady jako substancje, które dysocjują tworząc jony OH-. To doskonały punkt wyjścia do wyjaśnienia, dlaczego HNO3 jest kwasem.
Używaj wizualizacji. Rysowanie schematów cząsteczek HNO3, wody, oraz powstałych jonów H3O+ i NO3- pomaga uczniom zrozumieć proces na poziomie molekularnym. Można wykorzystać modele 3D cząsteczek lub animacje komputerowe.
Przeprowadź prosty eksperyment. Pomiar pH roztworu kwasu azotowego(V) pomoże uczniom zobaczyć, że kwas ten jest mocny. Użyj wskaźników pH, aby pokazać, jak zmienia się kolor roztworu w zależności od jego kwasowości. Pamiętaj o zachowaniu wszelkich środków ostrożności podczas pracy z kwasami.
Unikanie Typowych Błędów
Częstym błędem jest mylenie dysocjacji jonowej z rozpuszczaniem. Wyjaśnij, że rozpuszczanie to jedynie mieszanie się substancji z rozpuszczalnikiem, podczas gdy dysocjacja to rozpad na jony. Uczniowie muszą zrozumieć, że dysocjacja jest procesem chemicznym, a nie tylko fizycznym.
Inny błąd to myślenie, że wszystkie kwasy dysocjują w 100%. Podkreśl, że moc kwasu zależy od stopnia dysocjacji. Kwas azotowy(V) jest mocnym kwasem, co oznacza, że dysocjuje w dużym stopniu, ale nie całkowicie.
Upewnij się, że uczniowie rozumieją różnicę między jonami a atomami. Jony to atomy lub grupy atomów, które mają ładunek elektryczny, a atomy są obojętne elektrycznie. Wyjaśnij, jak atomy zyskują lub tracą elektrony, stając się jonami.
Jak Uatrakcyjnić Lekcję?
Użyj analogii z życia codziennego. Możesz porównać dysocjację jonową do rozpuszczania soli w wodzie, gdzie sól rozpada się na jony sodu i chlorku. To pomoże uczniom zrozumieć ideę rozpadu na mniejsze części.
Zorganizuj quiz lub grę. Zadawaj pytania dotyczące równań dysocjacji, jonów powstających podczas dysocjacji HNO3 i definicji kwasów. To sprawi, że nauka będzie bardziej interaktywna i angażująca.
Wykorzystaj technologię. Znajdź interaktywne symulacje dysocjacji jonowej online. To pozwoli uczniom zobaczyć proces w dynamiczny sposób i eksperymentować z różnymi warunkami.
Powiązanie z Praktycznym Zastosowaniem
Podkreśl, że kwas azotowy(V) ma wiele zastosowań w przemyśle. Używany jest do produkcji nawozów, materiałów wybuchowych, tworzyw sztucznych i wielu innych produktów. Wyjaśnij, że zrozumienie dysocjacji jonowej jest kluczowe dla zrozumienia tych procesów.
Możesz wspomnieć o roli kwasu azotowego(V) w procesach nitrowania, które są wykorzystywane do produkcji materiałów wybuchowych, takich jak trotyl (TNT). To pokaże uczniom, jak wiedza o dysocjacji jonowej przekłada się na praktyczne zastosowania w przemyśle chemicznym.
Porozmawiaj o wpływie kwasów na środowisko. Wyjaśnij, jak kwaśne deszcze powstają w wyniku emisji tlenków azotu i siarki do atmosfery. To pomoże uczniom zrozumieć, jak ważne jest kontrolowanie emisji zanieczyszczeń i ochrona środowiska.
Pamiętaj, aby dostosować poziom trudności do wieku i wiedzy uczniów. Staraj się używać prostego języka i unikać zbyt skomplikowanych terminów. Najważniejsze, aby uczniowie zrozumieli podstawowe zasady dysocjacji jonowej i potrafili ją zastosować w praktyce.
Mamy nadzieję, że ten artykuł pomoże Wam w skutecznym nauczaniu o dysocjacji jonowej kwasu azotowego(V). Powodzenia!