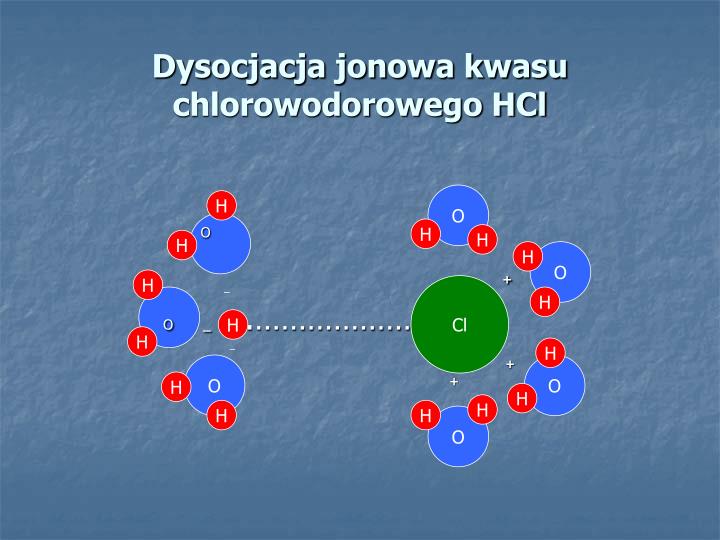
Hej! Zastanawialiście się kiedyś, co sprawia, że ocet ma kwaśny smak? Albo dlaczego sok z cytryny jest taki orzeźwiający? Odpowiedź tkwi w kwasach karboksylowych i ich zdolności do dysocjacji jonowej. Brzmi skomplikowanie? Bez obaw, zaraz to wszystko rozłożymy na czynniki pierwsze.
Czym są kwasy karboksylowe?
Kwasy karboksylowe to organiczne związki chemiczne. Charakteryzują się obecnością grupy funkcyjnej zwanej grupą karboksylową. Ta grupa składa się z atomu węgla (C), który jest połączony wiązaniem podwójnym z atomem tlenu (O) oraz wiązaniem pojedynczym z grupą hydroksylową (OH). Zapisujemy ją najczęściej jako -COOH. Przykładem znanego kwasu karboksylowego jest kwas octowy (znajdujący się w occie) czy kwas cytrynowy (w cytrynach).
Pomyśl o kwasie karboksylowym jak o samochodzie z przyczepą. "Samochód" to reszta cząsteczki, a "przyczepa" to właśnie grupa -COOH. Ta "przyczepa" decyduje o kwasowych właściwościach związku. Im więcej grup karboksylowych w cząsteczce, tym potencjalnie silniejszy kwas. Ale to nie wszystko - ważna jest też wspomniana dysocjacja jonowa.
Dysocjacja jonowa – co to takiego?
Dysocjacja jonowa to proces rozpadu związku chemicznego na jony w roztworze. Dzieje się to, gdy związek rozpuszcza się w wodzie lub innym rozpuszczalniku polarnym. W przypadku kwasów karboksylowych chodzi o odłączenie jonu wodoru (H+) od grupy karboksylowej (-COOH). To właśnie obecność jonów H+ w roztworze sprawia, że roztwór ma kwaśny odczyn.
Wyobraź sobie, że masz magnes (cząsteczkę kwasu karboksylowego) i od niego odrywasz mały kawałek metalu (jon H+). Kawałek metalu teraz swobodnie "pływa" (jest w roztworze). Im więcej kawałków metalu uda Ci się oderwać, tym "silniejszy" magnes w kontekście dysocjacji. Podobnie jest z kwasami – im więcej jonów H+ się odłącza, tym kwas jest mocniejszy.
Równanie dysocjacji kwasu karboksylowego
Proces dysocjacji możemy zapisać za pomocą równania chemicznego. Dla ogólnego kwasu karboksylowego (R-COOH) wygląda to tak:
R-COOH ⇌ R-COO- + H+
Gdzie:
- R oznacza resztę cząsteczki (to, co pozostało z kwasu po odłączeniu grupy karboksylowej),
- R-COOH to cząsteczka kwasu karboksylowego,
- R-COO- to anion karboksylanowy (cząsteczka kwasu po odłączeniu jonu H+),
- H+ to jon wodorowy (proton).
Strzałka w obie strony (⇌) oznacza, że jest to proces odwracalny. Oznacza to, że część jonów wodorowych i anionów karboksylanowych może się z powrotem połączyć, tworząc z powrotem cząsteczkę kwasu. Stan równowagi (czyli stosunek ilości jonów do ilości niezdysocjowanych cząsteczek kwasu) zależy od mocy kwasu.
Moc kwasu karboksylowego
Moc kwasu karboksylowego zależy od tego, jak łatwo oddaje jon H+. Im łatwiej się to dzieje, tym kwas jest mocniejszy. Miarą mocy kwasu jest stała dysocjacji kwasowej (Ka). Im wyższa wartość Ka, tym mocniejszy kwas. Możemy również używać pKa, gdzie pKa = -log(Ka). Niższa wartość pKa oznacza mocniejszy kwas.
Na przykład, kwas octowy (Ka = 1.8 x 10-5) jest słabszy od kwasu mrówkowego (Ka = 1.8 x 10-4). Oznacza to, że kwas mrówkowy łatwiej oddaje jon H+ niż kwas octowy.
Czynniki wpływające na moc kwasu to między innymi: efekt indukcyjny (obecność grup przyciągających lub oddających elektrony w pobliżu grupy karboksylowej) oraz stabilizacja anionu karboksylanowego (im bardziej stabilny jest anion, tym łatwiej powstaje, a więc kwas jest mocniejszy).
Przykłady z życia codziennego
Wiele kwasów karboksylowych spotykamy na co dzień. Kwas octowy (CH3COOH) to główny składnik octu, używanego w kuchni do marynowania i przyprawiania potraw. Kwas cytrynowy (C6H8O7) występuje w owocach cytrusowych, nadając im kwaśny smak. Jest również używany jako konserwant i dodatek do żywności.
Kwas mlekowy (C3H6O3) powstaje w mięśniach podczas intensywnego wysiłku fizycznego, powodując zakwasy. Jest także wykorzystywany w przemyśle spożywczym, np. do produkcji jogurtów. Kwas benzoesowy (C7H6O2) jest stosowany jako konserwant w produktach spożywczych i kosmetykach.
Mam nadzieję, że teraz dysocjacja jonowa kwasów karboksylowych jest dla Was bardziej zrozumiała. Pamiętajcie, że to proces, w którym kwas oddaje jon H+, co sprawia, że roztwór staje się kwaśny. Zrozumienie tego zjawiska pozwala lepiej zrozumieć właściwości kwasów i ich zastosowanie w życiu codziennym.