Hej Studencie! Przygotowujesz się do egzaminu z chemii? Świetnie! Pomożemy Ci zrozumieć budowę atomu, a konkretnie, jak narysować atom z pięcioma protonami.
Podstawy Budowy Atomu
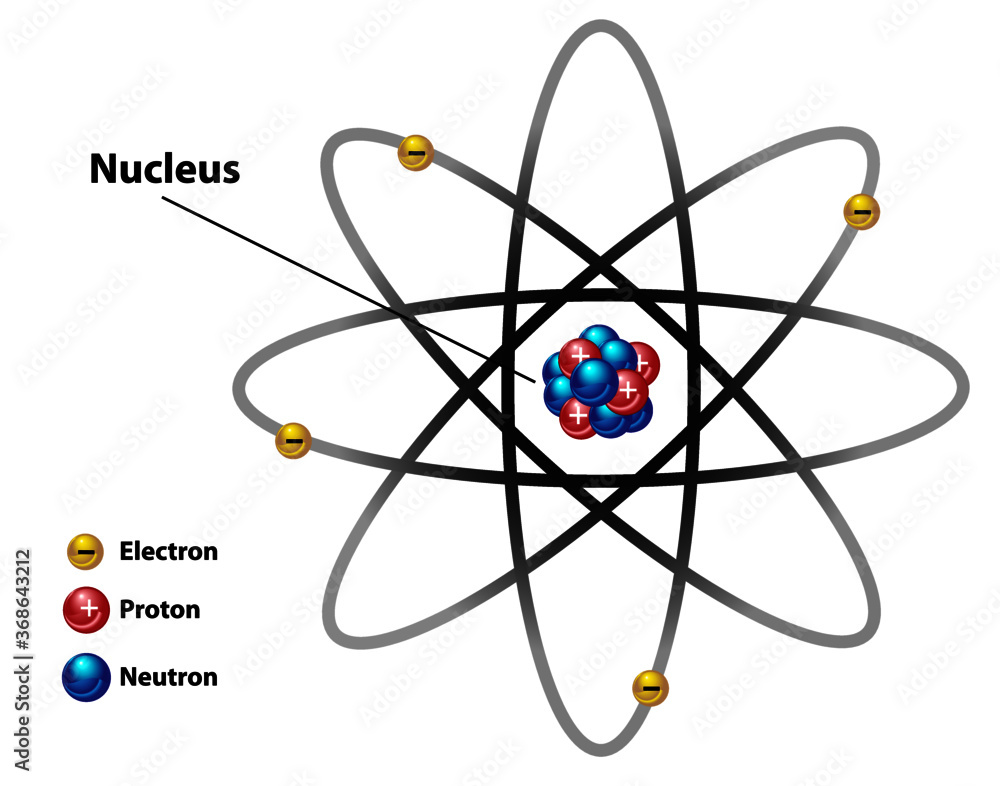
Zacznijmy od podstaw. Atom składa się z trzech głównych części.
Są to protony, neutrony i elektrony.
Protony i neutrony znajdują się w jądrze atomowym.
Elektrony krążą wokół jądra na orbitalach.
Protony
Protony mają ładunek dodatni (+1).
Liczba protonów w jądrze atomowym determinuje, jaki to pierwiastek.
Na przykład, każdy atom z jednym protonem to wodór.
Atom z dwoma protonami to hel.
A atom z pięcioma protonami...? O tym za chwilę!
Neutrony
Neutrony nie mają ładunku (są neutralne).
Znajdują się w jądrze atomowym wraz z protonami.
Neutrony wpływają na masę atomu.
Atomy tego samego pierwiastka mogą mieć różną liczbę neutronów. Nazywamy je izotopami.
Elektrony
Elektrony mają ładunek ujemny (-1).
Krążą wokół jądra na orbitalach.
Liczba elektronów w atomie neutralnym jest równa liczbie protonów.
To dlatego, że ładunki się równoważą!
Rysowanie Atomu z Pięcioma Protonami
Skoro już znasz podstawy, przejdźmy do sedna sprawy.
Chcemy narysować atom z pięcioma protonami.
Pierwszy krok: zidentyfikuj pierwiastek.
Identyfikacja Pierwiastka
Szukamy pierwiastka, który ma 5 protonów.
Do tego celu potrzebujemy układu okresowego pierwiastków.
Sprawdź w układzie okresowym, który pierwiastek ma liczbę atomową 5.
Znajdziesz tam bor (B)!
Bor ma 5 protonów w jądrze atomowym.
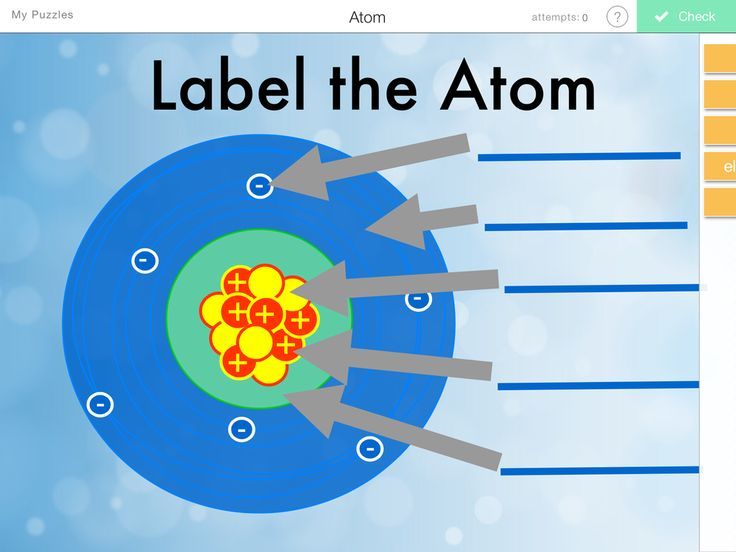
Rysowanie Jądra Atomowego
Narysuj okrąg. To będzie jądro atomowe.
Wewnątrz okręgu narysuj 5 protonów.
Możesz je oznaczyć jako "p+" lub po prostu "+".
Teraz musimy dodać neutrony.
Liczba Neutronów
Bor ma kilka izotopów.
Najczęściej występuje 11B.
Liczba masowa (11) to suma protonów i neutronów.
Więc liczba neutronów = liczba masowa - liczba protonów = 11 - 5 = 6.
W jądrze narysuj 6 neutronów. Oznacz je "n" lub "0".
Rysowanie Elektronów
Atom boru (B) ma 5 protonów, więc w atomie neutralnym musi mieć 5 elektronów.
Elektrony krążą wokół jądra na orbitalach.
Pierwsza powłoka (K) może pomieścić maksymalnie 2 elektrony.
Druga powłoka (L) może pomieścić maksymalnie 8 elektronów.
Narysuj dwie powłoki wokół jądra.
Na pierwszej powłoce umieść 2 elektrony (oznacz je "e-" lub "-").
Na drugiej powłoce umieść 3 elektrony (5 - 2 = 3).
Kompletny Rysunek
Gratulacje! Narysowałeś atom boru (B) z 5 protonami.
Pamiętaj, że to uproszczony model.
Orbitale elektronowe są bardziej skomplikowane.
Przykładowe Zadania Egzaminacyjne
Oto kilka przykładowych zadań, które mogą pojawić się na egzaminie:
- Narysuj atom azotu (N).
- Ile protonów, neutronów i elektronów ma atom 14C?
- Wyjaśnij różnicę między izotopem a jonem.
Wskazówki Egzaminacyjne
Pamiętaj o kilku ważnych rzeczach:
Układ okresowy pierwiastków jest Twoim najlepszym przyjacielem.
Liczba protonów determinuje pierwiastek.
Atom neutralny ma tyle samo protonów co elektronów.
Liczba masowa to suma protonów i neutronów.
Ćwicz rysowanie atomów różnych pierwiastków.
Podsumowanie
Omówiliśmy budowę atomu, skupiając się na protonach, neutronach i elektronach.
Nauczyliśmy się, jak narysować atom z 5 protonami (bor).
Poznaliśmy kilka ważnych definicji, takich jak izotop i liczba masowa.
Pamiętaj, ćwiczenie czyni mistrza! Powodzenia na egzaminie!
Pamiętaj! Zawsze możesz wrócić do tego artykułu, jeśli będziesz potrzebował przypomnienia.
Wierzę w Ciebie! Dasz radę!