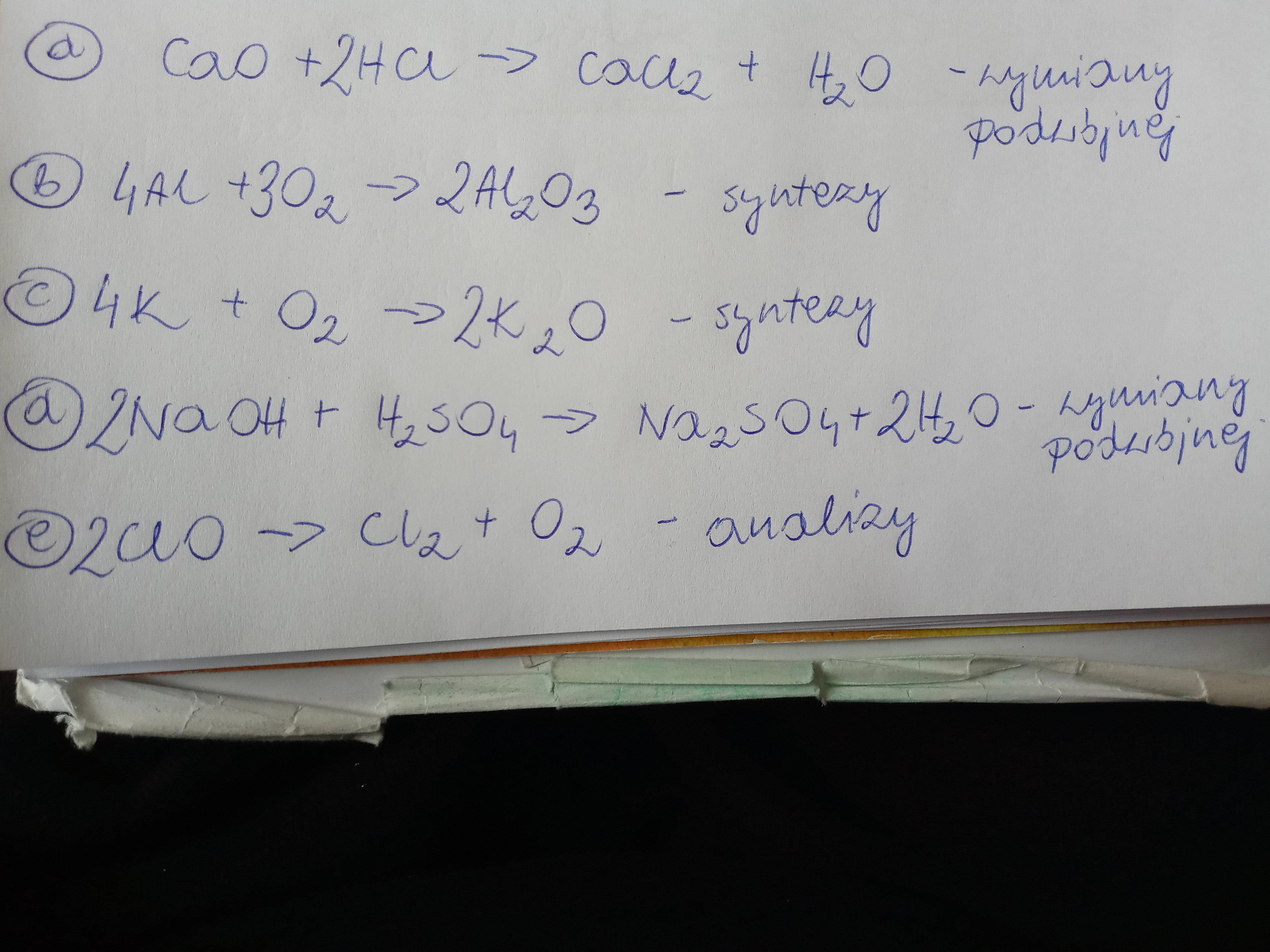Chemia może wydawać się skomplikowana, ale z odpowiednim podejściem, nawet najbardziej zagmatwane zagadnienia staną się zrozumiałe.
Zacznijmy od równań reakcji chemicznych.
Wyobraź sobie przepis na ciasto. Masz listę składników (reaktanty) i instrukcję, jak je połączyć, aby otrzymać gotowe ciasto (produkty).
Równanie reakcji to taki przepis, tylko dla reakcji chemicznych.
Na przykład, spalanie metanu (gaz ziemny) w obecności tlenu:
CH4 + O2 → CO2 + H2O
To tylko "szkielet" równania.
Teraz pojawia się kwestia współczynników stechiometrycznych.
Pomyśl o tym tak: przepis na ciasto mówi, ile mąki, jajek i cukru potrzebujesz.
Współczynniki stechiometryczne to liczby, które stawiamy przed wzorami chemicznymi, aby "zbalansować" równanie.
Balansowanie polega na tym, że po obu stronach równania (przed i po strzałce) musi być tyle samo atomów każdego pierwiastka.
Dlaczego to takie ważne?
Ponieważ prawo zachowania masy mówi, że atomy nie znikają ani nie pojawiają się w trakcie reakcji chemicznej.
Po prostu zmieniają swoje "kombinacje".
Jak Dobrać Współczynniki?
To jak rozwiązywanie zagadki. Zacznijmy od przykładu.
Przykład 1: Spalanie Metanu
Mamy równanie: CH4 + O2 → CO2 + H2O
Krok 1: Sprawdź, czy liczba atomów każdego pierwiastka jest taka sama po obu stronach.
Po lewej stronie mamy: 1 atom węgla (C), 4 atomy wodoru (H), 2 atomy tlenu (O).
Po prawej stronie mamy: 1 atom węgla (C), 2 atomy wodoru (H), 3 atomy tlenu (O).
Widzimy, że wodór i tlen nie są zbalansowane.
Krok 2: Zacznij balansować, zwykle od pierwiastków, które występują w mniejszej ilości związków.
Zacznijmy od wodoru. Po lewej stronie mamy 4 atomy H, a po prawej 2.
Aby to wyrównać, dodamy współczynnik 2 przed H2O:
CH4 + O2 → CO2 + 2H2O
Teraz mamy po lewej: 1 C, 4 H, 2 O.
A po prawej: 1 C, 4 H, 4 O (2 z CO2 i 2 z 2H2O).
Wodór jest zbalansowany, ale tlen wciąż nie.
Krok 3: Zbalansuj tlen.
Po lewej stronie mamy 2 atomy O, a po prawej 4.
Dodamy współczynnik 2 przed O2:
CH4 + 2O2 → CO2 + 2H2O
Krok 4: Sprawdź jeszcze raz.
Po lewej: 1 C, 4 H, 4 O.
Po prawej: 1 C, 4 H, 4 O.
Gratulacje! Równanie jest zbalansowane.
Zbalansowane równanie: CH4 + 2O2 → CO2 + 2H2O
Przykład 2: Powstawanie Wody
Równanie: H2 + O2 → H2O
Po lewej: 2 H, 2 O.
Po prawej: 2 H, 1 O.
Tlen nie jest zbalansowany. Dodajmy 2 przed H2O:
H2 + O2 → 2H2O
Teraz mamy po prawej: 4 H, 2 O.
Wodór też się rozbalansował. Dodajmy 2 przed H2:
2H2 + O2 → 2H2O
Sprawdzamy: Po lewej: 4 H, 2 O. Po prawej: 4 H, 2 O.
Zbalansowane równanie: 2H2 + O2 → 2H2O
Wskazówki i Triki
Zacznij od bardziej skomplikowanych związków.
Jeżeli masz związki z atomami występującymi w wielu miejscach, zostaw je na koniec.
Często przydatne jest użycie ułamków, które potem można "usunąć" mnożąc całe równanie przez odpowiednią liczbę.
Pamiętaj, że zmieniasz tylko współczynniki, nigdy indeksy we wzorach chemicznych!
Ćwicz, ćwicz, ćwicz! Im więcej zadań rozwiążesz, tym szybciej i łatwiej będzie Ci to przychodzić.
Balansowanie równań reakcji to umiejętność, którą warto opanować. To podstawa do dalszych obliczeń stechiometrycznych i zrozumienia zachodzących reakcji.
Powodzenia!