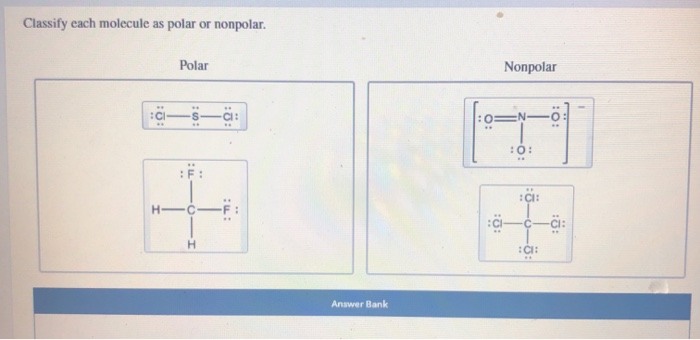
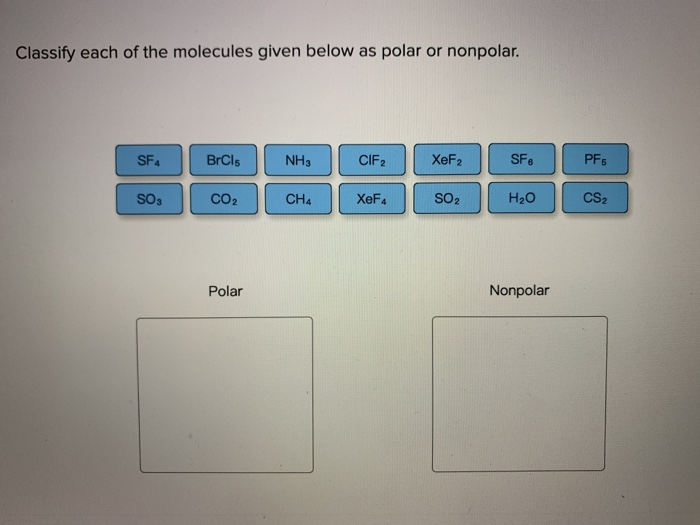
Hej! Zastanawiasz się, czy cząsteczka jest polarna, czy niepolarna? To wcale nie jest takie trudne! Wyobraź sobie, że cząsteczki to małe magnesy.
Polarność opisuje, czy magnes ma dwa wyraźne końce – biegun dodatni i biegun ujemny. Cząsteczki polarne zachowują się podobnie.
Niepolarność, to z kolei magnes, który nie ma wyraźnie zaznaczonych biegunów. Elektronami dzielimy się po równo.
Jak to rozpoznać?
Kluczem jest elektroujemność. To siła, z jaką atom przyciąga elektrony.
Wyobraź sobie dwa atomy, które chcą się połączyć. Mocniejszy atom (ten bardziej elektroujemny) "ciągnie" elektrony do siebie silniej.
Jeśli jeden atom jest znacznie silniejszy od drugiego, powstaje cząsteczka polarna. Jeśli obaj są równie silni, mamy cząsteczkę niepolarną.
Przykłady!
Spójrzmy na kilka przykładów, żeby to lepiej zrozumieć. Użyjemy rysunków i prostych porównań.
Woda (H2O)
Woda to klasyczny przykład cząsteczki polarnej. Tlen (O) jest dużo bardziej elektroujemny niż wodór (H).
Wyobraź sobie, że tlen to silny zawodnik sumo, a wodory to mali chłopcy. Sumo "ciągnie" elektrony od chłopców, tworząc na tlenie częściowy ładunek ujemny (δ-) i na wodorach częściowe ładunki dodatnie (δ+).
Cząsteczka wody przypomina literę "V". Tlen jest na wierzchołku, a wodory na końcach ramion. Dzięki tej asymetrii i różnicy elektroujemności, woda jest polarna.
Woda doskonale rozpuszcza inne substancje polarne, jak sól. Pamiętasz, jak sól rozpuszcza się w wodzie? To dlatego, że bieguny cząsteczek wody "przyciągają" jony sodu (Na+) i chlorku (Cl-) z soli.
Dwutlenek węgla (CO2)
Dwutlenek węgla to przykład, który może być mylący. Tlen jest bardziej elektroujemny niż węgiel (C), więc wydawałoby się, że CO2 jest polarny, prawda?
Ale! Cząsteczka CO2 ma budowę liniową. To znaczy, że atom węgla jest w środku, a dwa atomy tlenu po obu stronach.
Wyobraź sobie, że węgiel to środek liny, a tleny to dwie osoby ciągnące linę w przeciwne strony z równą siłą. Siły się równoważą!
Mimo że wiązania C=O są polarne, to symetria cząsteczki sprawia, że cała cząsteczka CO2 jest niepolarna. To jak idealne przeciwwagi.
Metan (CH4)
Metan to bardzo prosta cząsteczka. Składa się z jednego atomu węgla i czterech atomów wodoru.
Różnica elektroujemności między węglem a wodorem nie jest duża. A cząsteczka ma budowę tetraedryczną – wyobraź sobie piramidę, gdzie węgiel jest na szczycie, a wodory w rogach podstawy.
Dzięki tej symetrycznej budowie i niewielkiej różnicy elektroujemności, metan jest cząsteczką niepolarną.
Metan jest głównym składnikiem gazu ziemnego. Gazu ziemnego nie miesza się dobrze z wodą (która jest polarna). To dlatego ropa naftowa (zawierająca dużo alkanów, podobnych do metanu) nie miesza się z wodą!
Amoniak (NH3)
Amoniak, czyli NH3. Azot (N) jest bardziej elektroujemny niż wodór (H).
Cząsteczka amoniaku ma kształt piramidy. Azot jest na wierzchołku, a trzy wodory w rogach podstawy. Ten kształt to kluczowa różnica w porównaniu do płaskiego trójkąta.
Ta asymetryczna budowa i fakt, że azot jest bardziej elektroujemny, sprawiają, że amoniak jest cząsteczką polarną. Elektronami dzielimy się niesprawiedliwie.
Podsumowanie
Żeby określić polarność, pamiętaj o tych krokach:
- Sprawdź elektroujemność atomów w cząsteczce.
- Zwróć uwagę na kształt cząsteczki. Czy jest symetryczny?
- Pamiętaj, że wiązania polarne mogą się znosić w symetrycznej cząsteczce.
Polarność cząsteczek wpływa na ich właściwości, takie jak rozpuszczalność, temperatura wrzenia i reaktywność.
Mam nadzieję, że teraz lepiej rozumiesz, jak klasyfikować cząsteczki jako polarne lub niepolarne! Powodzenia!