Witajcie! Przygotowujemy się do sprawdzianu z chemii? Świetnie! Skupimy się na wodzie i roztworach wodnych. Pamiętajcie, damy radę!
Woda – niezwykła substancja
Woda to H2O. Pamiętajcie ten wzór! Jest podstawą życia.
Budowa cząsteczki wody jest polarna. To oznacza, że tlen ma lekką ładunek ujemny (δ-), a wodory lekkie ładunki dodatnie (δ+).
Wiązania wodorowe powstają między cząsteczkami wody. To dlatego woda ma tak niezwykłe właściwości.
Właściwości wody
Woda ma wysokie napięcie powierzchniowe. To sprawia, że owady mogą chodzić po wodzie.
Ma też wysokie ciepło właściwe. Ogrzewa się i stygnie powoli.
Woda jest rozpuszczalnikiem polarnym. Rozpuszcza substancje polarne i jonowe.
Gęstość wody jest największa w temperaturze 4°C. Dlatego lód pływa po wodzie.
Roztwory wodne
Roztwór to mieszanina jednorodna. Składa się z rozpuszczalnika i substancji rozpuszczonej.
Woda jest często rozpuszczalnikiem. Mówimy wtedy o roztworze wodnym.
Rodzaje roztworów
Roztwór nienasycony: można jeszcze rozpuścić więcej substancji.
Roztwór nasycony: nie można już rozpuścić więcej substancji w danej temperaturze.
Roztwór przesycony: zawiera więcej substancji niż roztwór nasycony (jest nietrwały).
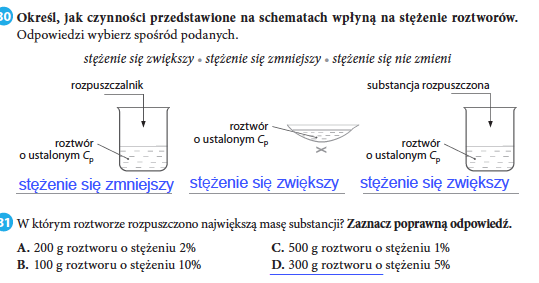
Stężenia roztworów
Stężenie procentowe (Cp): masa substancji rozpuszczonej w 100 g roztworu.
Wzór: Cp = (ms / mr) * 100%, gdzie ms to masa substancji, a mr to masa roztworu.
Stężenie molowe (Cm): liczba moli substancji rozpuszczonej w 1 dm3 roztworu.
Wzór: Cm = n / V, gdzie n to liczba moli, a V to objętość roztworu (w dm3).
Rozpuszczalność
Rozpuszczalność to maksymalna masa substancji, którą można rozpuścić w danej ilości rozpuszczalnika w danej temperaturze.
Rozpuszczalność zależy od temperatury i rodzaju substancji.
Dla większości ciał stałych rozpuszczalność rośnie wraz z temperaturą. Dla gazów – maleje.
Dysocjacja elektrolityczna
Elektrolity to substancje, które rozpuszczone w wodzie przewodzą prąd elektryczny.
Dysocjacja elektrolityczna to rozpad elektrolitu na jony pod wpływem wody.
Przykłady elektrolitów: kwasy, zasady, sole.
Kwasy dysocjują na kationy wodoru (H+) i aniony reszty kwasowej.
Zasady dysocjują na kationy metalu i aniony wodorotlenkowe (OH-).
Sole dysocjują na kationy metalu i aniony reszty kwasowej.
Stopień dysocjacji (α)
Stopień dysocjacji to stosunek liczby cząsteczek, które uległy dysocjacji, do całkowitej liczby cząsteczek wprowadzonych do roztworu.
α = (liczba cząsteczek zdysocjowanych) / (liczba cząsteczek wprowadzonych)
Mocne elektrolity dysocjują w dużym stopniu (α ≈ 1). Przykład: HCl, NaOH.
Słabe elektrolity dysocjują w niewielkim stopniu (α < 1). Przykład: CH3COOH, NH3.
Reakcje w roztworach wodnych
Reakcje strąceniowe: powstaje osad, czyli substancja nierozpuszczalna.
Reakcje zobojętniania: reakcja kwasu z zasadą, w wyniku której powstaje sól i woda.
Równanie jonowe i równanie jonowe skrócone pokazują, które jony biorą udział w reakcji.
Przykłady obliczeń
Oblicz stężenie procentowe roztworu, w którym rozpuszczono 20 g soli w 80 g wody.
mr = ms + mw = 20 g + 80 g = 100 g
Cp = (ms / mr) * 100% = (20 g / 100 g) * 100% = 20%
Oblicz stężenie molowe roztworu, w którym rozpuszczono 0,5 mola substancji w 2 dm3 roztworu.
Cm = n / V = 0,5 mola / 2 dm3 = 0,25 mol/dm3
Kluczowe pojęcia – powtórka
Pamiętajcie o:
- Budowie cząsteczki wody (polarność, wiązania wodorowe)
- Właściwościach wody (napięcie powierzchniowe, ciepło właściwe, rozpuszczalność)
- Rodzajach roztworów (nienasycony, nasycony, przesycony)
- Stężeniach roztworów (procentowe, molowe)
- Rozpuszczalności
- Dysocjacji elektrolitycznej (elektrolity, kwasy, zasady, sole, stopień dysocjacji)
- Reakcjach w roztworach wodnych (strąceniowe, zobojętniania)
Podsumowanie
Uff, sporo tego! Ale spokojnie, przeczytajcie to jeszcze raz. Zróbcie kilka zadań. Powodzenia na sprawdzianie! Wierzę w Was!
Pamiętajcie, że kluczem do sukcesu jest zrozumienie, a nie tylko zapamiętanie. Powodzenia!