Witaj! Zbliża się sprawdzian z Chemii Nowej Ery 2, a jednym z kluczowych tematów są wodorotlenki. Nie martw się, rozłożymy ten temat na czynniki pierwsze, abyś bez problemu mógł zrozumieć i zaliczyć sprawdzian.
Czym są wodorotlenki?
Wodorotlenki to związki chemiczne. Są zbudowane z metalu i grupy wodorotlenowej (OH). Ta grupa wodorotlenowa, czyli OH-, jest bardzo charakterystyczna dla wodorotlenków. Dzięki niej wiemy, że mamy do czynienia z wodorotlenkiem.
Wyobraź sobie, że masz klocki LEGO. Metal to jeden klocek, a grupa OH to drugi. Połącz te klocki, a otrzymasz wodorotlenek. Ilość grup OH zależy od wartościowości metalu.
Wartościowość - podstawa wzorów
Wartościowość to liczba wiązań, które atom danego pierwiastka może utworzyć. Pomyśl o tym jak o liczbie "rąk", którymi dany atom może się "przyczepić" do innych atomów. Grupa wodorotlenowa (OH) ma zawsze wartościowość I. Metal natomiast może mieć różną wartościowość. To od wartościowości metalu zależy, ile grup OH będzie potrzebnych do utworzenia wodorotlenku.
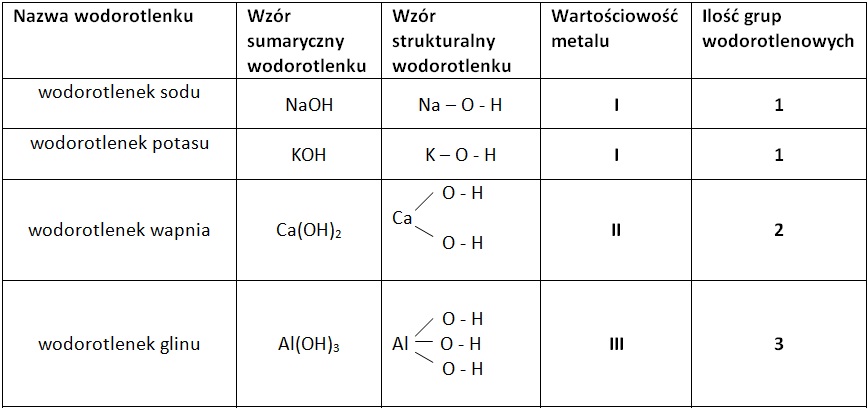
Na przykład, sód (Na) ma wartościowość I. Dlatego wodorotlenek sodu ma wzór NaOH (jeden Na i jedna grupa OH). Magnez (Mg) ma wartościowość II. Dlatego wodorotlenek magnezu ma wzór Mg(OH)2 (jeden Mg i dwie grupy OH). Nawiasy i indeks dolny (2) oznaczają, że grupa OH jest powtórzona dwa razy.
Jak tworzyć wzory wodorotlenków?
Proces tworzenia wzorów wodorotlenków jest prosty. Najpierw zapisujesz symbol metalu. Potem zapisujesz grupę OH. Następnie patrzysz na wartościowość metalu. Jeśli metal ma wartościowość większą niż I, musisz wziąć w nawias grupę OH i zapisać w indeksie dolnym wartościowość metalu. Brzmi skomplikowanie? Spójrz na przykłady.
Przykład 1: Wodorotlenek potasu. Potas (K) ma wartościowość I. Wzór to KOH.
Przykład 2: Wodorotlenek wapnia. Wapń (Ca) ma wartościowość II. Wzór to Ca(OH)2. Zauważ nawias i "2" w indeksie dolnym!
Przykład 3: Wodorotlenek glinu. Glin (Al) ma wartościowość III. Wzór to Al(OH)3. Znowu nawias i "3"!
Nazewnictwo wodorotlenków
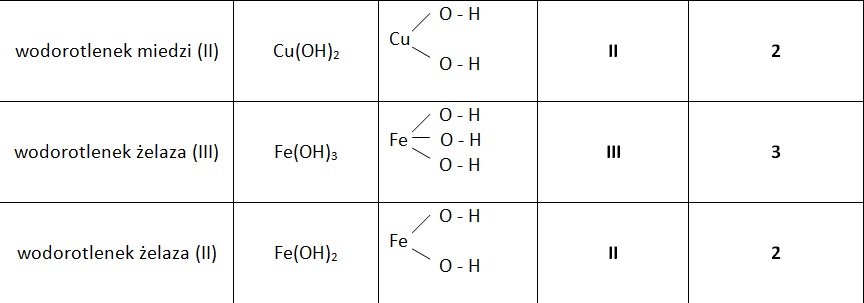
Nazwa wodorotlenku jest prosta. Składa się z dwóch słów: "wodorotlenek" i nazwa metalu w dopełniaczu. Dopełniacz odpowiada na pytanie "kogo? czego?". Czyli np. "wodorotlenek sodu", "wodorotlenek potasu", "wodorotlenek żelaza(II)".
Jeśli metal ma więcej niż jedną wartościowość, trzeba to zaznaczyć w nazwie. Robi się to, pisząc wartościowość metalu w nawiasie, cyframi rzymskimi. Na przykład, żelazo (Fe) może mieć wartościowość II lub III. Dlatego mamy wodorotlenek żelaza(II) (Fe(OH)2) i wodorotlenek żelaza(III) (Fe(OH)3).
Właściwości wodorotlenków
Wodorotlenki mają charakter zasadowy. Oznacza to, że mają odczyn zasadowy. To dlatego mydło, które często zawiera wodorotlenek sodu lub potasu, jest śliskie w dotyku. W roztworach wodnych dysocjują na kationy metalu i aniony wodorotlenkowe (OH-). Obecność tych anionów OH- powoduje zasadowy odczyn roztworu.
Wodorotlenki metali grupy pierwszej (litowce) i drugiej (beryl, magnez, wapń, stront, bar) są dobrze rozpuszczalne w wodzie. Nazywamy je zasadami. Pozostałe wodorotlenki są słabo rozpuszczalne lub nierozpuszczalne w wodzie. To bardzo ważna różnica, którą warto zapamiętać.
Przykłady wodorotlenków i ich zastosowania
Wodorotlenki mają wiele zastosowań w życiu codziennym i przemyśle. Oto kilka przykładów:
- Wodorotlenek sodu (NaOH), czyli soda żrąca. Używany do produkcji mydła, papieru, środków czyszczących i do udrażniania rur.
- Wodorotlenek potasu (KOH), czyli potaż żrący. Podobnie jak NaOH, używany w produkcji mydła (szczególnie mydeł w płynie), a także w akumulatorach alkalicznych.
- Wodorotlenek wapnia (Ca(OH)2), czyli wapno gaszone. Używany w budownictwie (do zapraw murarskich), rolnictwie (do odkwaszania gleby) i w stomatologii.
- Wodorotlenek magnezu (Mg(OH)2). Znajduje się w lekach zobojętniających kwas żołądkowy (np. mleczko magnezjowe).
- Wodorotlenek glinu (Al(OH)3). Stosowany w kosmetykach (np. w antyperspirantach) i jako środek pomocniczy w leczeniu nadkwasoty żołądka.
Zauważ, że wiele z tych wodorotlenków ma zastosowanie w gospodarstwie domowym lub w medycynie. To pokazuje, jak ważna jest znajomość tych związków.
Reakcje charakterystyczne dla wodorotlenków
Wodorotlenki reagują z kwasami, tworząc sole i wodę. To reakcja zobojętniania. Można ją zapisać ogólnie jako: wodorotlenek + kwas → sól + woda.
Na przykład, wodorotlenek sodu (NaOH) reaguje z kwasem solnym (HCl), tworząc chlorek sodu (NaCl) i wodę (H2O). Równanie reakcji: NaOH + HCl → NaCl + H2O.
Wodorotlenki reagują również z tlenkami kwasowymi (bezwodnikami kwasowymi), tworząc sole. Na przykład, wodorotlenek wapnia (Ca(OH)2) reaguje z dwutlenkiem węgla (CO2), tworząc węglan wapnia (CaCO3) i wodę (H2O). To reakcja, która zachodzi podczas twardnienia zaprawy wapiennej.
Jak przygotować się do sprawdzianu?
Teraz, kiedy masz już solidne podstawy, czas przygotować się do sprawdzianu. Przede wszystkim, powtórz definicje. Upewnij się, że rozumiesz, czym są wodorotlenki, co to jest wartościowość i jak tworzyć wzory wodorotlenków.
Następnie, przećwicz pisanie wzorów wodorotlenków na podstawie nazw i odwrotnie. Spróbuj wziąć różne metale i napisać wzory ich wodorotlenków. Pamiętaj o wartościowości! Możesz także poprosić kogoś o sprawdzenie, czy dobrze to robisz.
Na koniec, zapoznaj się z właściwościami i zastosowaniami najważniejszych wodorotlenków. Wiedza o tym, gdzie w życiu codziennym można spotkać wodorotlenki, na pewno ci się przyda. Powodzenia na sprawdzianie!