Zaczynamy naszą podróż po kwasach! Wyobraź sobie, że kwasy to takie małe cegiełki.
Czym są kwasy?
Kwasy to substancje, które posiadają charakterystyczny smak. Często jest to smak kwaśny, jak cytryna. Pomyśl o occie w sałatce! To też kwas.
Patrząc chemicznie, kwasy oddają jony wodorowe (H+). Wyobraź sobie, że jon wodorowy to mały, pozytywnie naładowany krasnal, który szuka przyjaciół.
Dysocjacja kwasowa
Dysocjacja kwasowa to proces, w którym kwas rozpada się na jony w wodzie. To tak, jakby kwas dzielił się na swoje małe cegiełki. Znowu te jony wodorowe (H+)! Plus anion reszty kwasowej.
Na przykład, kwas solny (HCl) rozpada się na jon wodorowy (H+) i jon chlorkowy (Cl-). Wyobraź sobie to jak rozpadanie się zabawki na części.
Podział kwasów
Kwasy dzielimy na różne rodzaje.
Kwasy beztlenowe
To kwasy, które nie zawierają w swoim składzie atomów tlenu. Pamiętaj o nich jako o "nagich" kwasach!
Przykładem jest kwas solny (HCl). Widzisz? Nie ma tam tlenu.
Kwasy tlenowe (oksykwasy)
Kwasy tlenowe zawierają atomy tlenu. Są bardziej "ubrane" niż kwasy beztlenowe.
Przykładem jest kwas siarkowy(VI) (H2SO4). Widzisz te cztery atomy tlenu?
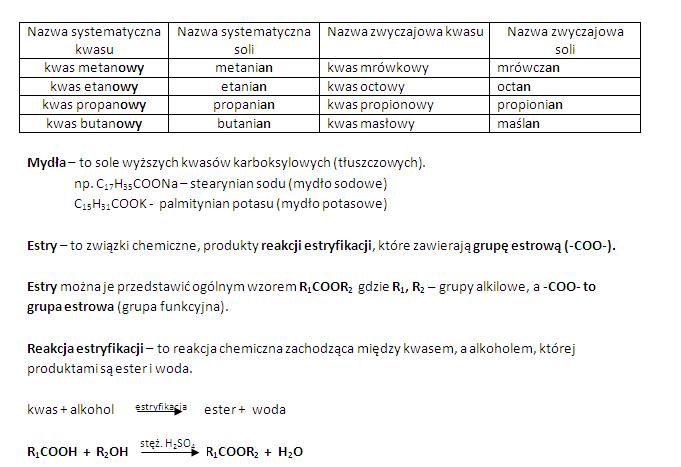
Kwasy organiczne
To kwasy, które zawierają węgiel. Występują powszechnie w przyrodzie.
Przykładem jest kwas octowy (CH3COOH), który znajdziemy w occie.
Moc kwasów
Moc kwasu zależy od tego, jak łatwo oddaje jony wodorowe (H+). Pomyśl o tym, jak o sile uścisku dłoni kwasu - im silniejszy, tym mocniejszy kwas.
Kwasy mocne
Kwasy mocne dysocjują całkowicie w wodzie. Oddają wszystkie swoje jony wodorowe.
Przykładami są kwas solny (HCl) i kwas siarkowy(VI) (H2SO4).
Kwasy słabe
Kwasy słabe dysocjują tylko częściowo. Oddają tylko część swoich jonów wodorowych.
Przykładem jest kwas octowy (CH3COOH).
Reakcje kwasów
Kwasy biorą udział w różnych reakcjach chemicznych. Wyobraź sobie, że to taniec kwasów z innymi substancjami!
Reakcja z metalami
Kwasy reagują z niektórymi metalami, tworząc sól i wodór. Pomyśl o tym, jak o zamianie miejsc w tańcu.
Na przykład: kwas solny + cynk -> chlorek cynku + wodór.
Reakcja z zasadami (neutralizacja)
Kwasy reagują z zasadami, tworząc sól i wodę. To tak, jakby kwas i zasada łączyły się w parę.
Na przykład: kwas solny + wodorotlenek sodu -> chlorek sodu + woda.
Reakcja z tlenkami metali
Kwasy reagują z tlenkami metali, tworząc sól i wodę. Kolejna para taneczna!
Na przykład: kwas solny + tlenek magnezu -> chlorek magnezu + woda.
Reakcja z węglanami
Kwasy reagują z węglanami, tworząc sól, wodę i dwutlenek węgla. Pomyśl o tym, jak o wybuchu radości podczas tańca!
Na przykład: kwas solny + węglan wapnia -> chlorek wapnia + woda + dwutlenek węgla.
Zastosowanie kwasów
Kwasy mają szerokie zastosowanie w przemyśle i życiu codziennym.
- Kwas solny (HCl): stosowany do czyszczenia metali i produkcji tworzyw sztucznych.
- Kwas siarkowy(VI) (H2SO4): stosowany w produkcji nawozów, detergentów i akumulatorów.
- Kwas octowy (CH3COOH): stosowany jako ocet spożywczy i do produkcji tworzyw sztucznych.
- Kwas cytrynowy (C6H8O7): występuje w owocach cytrusowych i stosowany jako dodatek do żywności.
Pamiętaj! Praca z kwasami wymaga ostrożności. Zawsze używaj odpowiednich środków ochrony osobistej!
Teraz, gdy masz już podstawową wiedzę o kwasach, możesz śmiało przystąpić do sprawdzianu. Powodzenia!