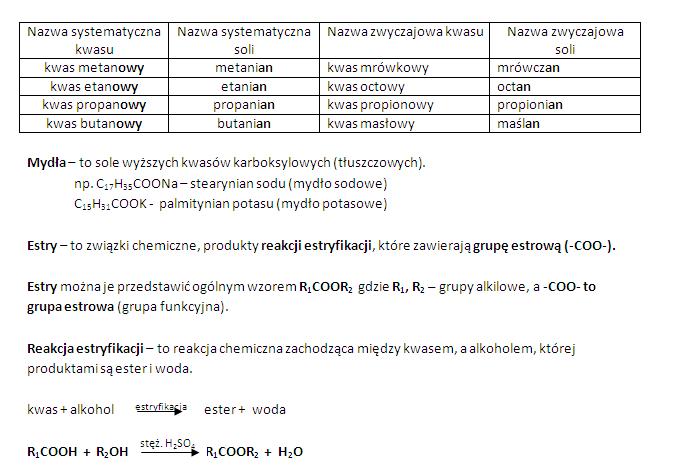
Hej! Przygotowujesz się do sprawdzianu z Chemii Nowej Ery 1? Super! To świetnie, że chcesz się do niego dobrze przygotować. Pomożemy Ci! Ten przewodnik to taki "ściągawkowy" przyjaciel, który pomoże Ci ogarnąć najważniejsze rzeczy.
Stechiometria - czyli co z czym reaguje
Stechiometria to dział chemii, który zajmuje się ilościowymi zależnościami między reagentami i produktami w reakcjach chemicznych.
Masa molowa
Masa molowa (M) – masa jednego mola danego związku chemicznego wyrażona w gramach na mol (g/mol). Znajdziesz ją w układzie okresowym!
Żeby obliczyć masę molową związku, dodaj masy molowe wszystkich atomów wchodzących w jego skład.
Np. dla wody (H2O): M(H2O) = 2 * M(H) + M(O) = 2 * 1 g/mol + 16 g/mol = 18 g/mol.
Mol
Mol (n) – jednostka liczności materii. Jeden mol zawiera 6,022 x 1023 (liczba Avogadro) atomów, cząsteczek, jonów, lub innych określonych obiektów.
Wzór: n = m/M, gdzie: n – liczba moli, m – masa substancji, M – masa molowa substancji.
Obliczenia stechiometryczne
Ustal równanie reakcji.
Oblicz masy molowe substancji, które nas interesują.
Ustal proporcje molowe między substancjami na podstawie równania reakcji.
Ustal proporcje masowe. Wykorzystaj proporcje molowe i masy molowe.
Oblicz masę lub liczbę moli szukanej substancji.
Przykład: Ile gramów tlenku magnezu (MgO) powstanie z 24 g magnezu (Mg)? 2Mg + O2 -> 2MgO M(Mg) = 24 g/mol, M(MgO) = 40 g/mol Z równania reakcji wynika, że 2 mole Mg dają 2 mole MgO, czyli 1 mol Mg daje 1 mol MgO 24 g Mg to 1 mol (24 g / 24 g/mol = 1 mol) Zatem powstanie 1 mol MgO, czyli 40 g MgO
Stężenia roztworów
Stężenie roztworu określa ilość substancji rozpuszczonej w danej ilości rozpuszczalnika lub roztworu.
Stężenie procentowe
Stężenie procentowe (Cp) – wyraża liczbę gramów substancji rozpuszczonej w 100 gramach roztworu.
Wzór: Cp = (ms / mr) * 100%, gdzie: ms – masa substancji, mr – masa roztworu.
Pamiętaj! Masa roztworu to masa substancji plus masa rozpuszczalnika (najczęściej wody): mr = ms + mw.
Stężenie molowe
Stężenie molowe (Cm) – wyraża liczbę moli substancji rozpuszczonej w 1 dm3 (litrze) roztworu.
Wzór: Cm = n/V, gdzie: n – liczba moli substancji, V – objętość roztworu w dm3.
Przeliczanie stężeń
Do przeliczania stężeń często potrzebna jest gęstość roztworu (d). Gęstość roztworu to masa 1 cm3 (lub 1 ml) roztworu wyrażona w g/cm3 (lub g/ml).
Wzór: d = mr/Vr, gdzie: mr – masa roztworu, Vr – objętość roztworu.
Przeliczanie Cp na Cm: Cm = (Cp * d * 10) / M, gdzie: Cp – stężenie procentowe, d – gęstość roztworu (g/cm3), M – masa molowa substancji.
Reakcje w roztworach wodnych - kwasy, zasady, sole
Kwasy – substancje, które w roztworach wodnych dysocjują na kationy wodoru (H+) i aniony reszty kwasowej.
Zasady – substancje, które w roztworach wodnych dysocjują na kationy metalu (lub kation amonowy NH4+) i aniony wodorotlenkowe (OH-).
Sole – związki chemiczne, które powstają w wyniku reakcji kwasu z zasadą (reakcja zobojętniania). Składają się z kationu metalu (lub kationu amonowego NH4+) i anionu reszty kwasowej.
Dysocjacja elektrolityczna
Dysocjacja elektrolityczna – rozpad związku chemicznego na jony pod wpływem rozpuszczalnika (np. wody).
Elektrolity – substancje, których roztwory wodne przewodzą prąd elektryczny (np. kwasy, zasady, sole).
Nielektrolity – substancje, których roztwory wodne nie przewodzą prądu elektrycznego (np. cukier, alkohol).
Równania reakcji jonowych
Równanie jonowe zapisuje reakcję z uwzględnieniem jonów.
Zapis cząsteczkowy: NaOH(aq) + HCl(aq) -> NaCl(aq) + H2O(l)
Zapis jonowy pełny: Na+(aq) + OH-(aq) + H+(aq) + Cl-(aq) -> Na+(aq) + Cl-(aq) + H2O(l)
Zapis jonowy skrócony: OH-(aq) + H+(aq) -> H2O(l)
Jony spectatorowe to jony, które występują po obu stronach równania jonowego i nie biorą udziału w reakcji.
Odczyn roztworu
Odczyn roztworu określa jego kwasowość lub zasadowość.
Skala pH – skala, która służy do określania odczynu roztworu. pH < 7 – odczyn kwasowy, pH = 7 – odczyn obojętny, pH > 7 – odczyn zasadowy.
Wskaźniki pH to substancje, które zmieniają barwę w zależności od odczynu roztworu (np. papierek uniwersalny, oranż metylowy, fenoloftaleina).
Podsumowanie najważniejszych zagadnień
Stechiometria: masa molowa, mol, obliczenia na podstawie równań reakcji.
Stężenia roztworów: stężenie procentowe, stężenie molowe, przeliczanie stężeń.
Reakcje w roztworach wodnych: kwasy, zasady, sole, dysocjacja elektrolityczna, równania reakcji jonowych, odczyn roztworu, skala pH.
Pamiętaj! Ćwicz, rozwiązuj zadania, a wszystko stanie się jasne! Powodzenia na sprawdzianie!