Chemia może wydawać się skomplikowana, szczególnie kiedy zaczynamy omawiać kwasy. Jednak, zrozumienie kwasów jest kluczowe, a ten artykuł pomoże Ci przygotować się do sprawdzianu z chemii w klasie 8, krok po kroku. Skupimy się na najważniejszych definicjach, właściwościach i przykładach.
Co to są kwasy?
Zacznijmy od podstaw. Kwasy to związki chemiczne, które rozpuszczone w wodzie tworzą jony wodorowe (H+). To właśnie obecność jonów H+ nadaje im charakterystyczne właściwości. Pomyśl o tym jak o specjalnym składniku, który zmienia zachowanie wody.
Dysocjacja jonowa to proces, w którym cząsteczka kwasu rozpada się na jony w wodzie. Na przykład, kwas solny (HCl) dysocjuje na jon wodorowy (H+) i jon chlorkowy (Cl-). To właśnie uwolnione jony wodorowe powodują, że roztwór staje się kwaśny.
Właściwości kwasów
Kwasy mają kilka charakterystycznych cech. Smak kwasów jest kwaśny, ale nigdy nie próbuj kwasów w laboratorium! To niebezpieczne! Kwaśny smak, który znasz z cytryny, wynika z obecności kwasu cytrynowego.
Kwasy reagują z metalami, tworząc wodór. Wyobraź sobie, że wrzucasz kawałek cynku do kwasu solnego. Będziesz obserwować wydzielanie się gazu – to właśnie wodór. Ta reakcja jest często wykorzystywana w eksperymentach chemicznych.
Kwasy zmieniają barwę wskaźników. Wskaźniki to substancje, które zmieniają kolor w zależności od pH roztworu. Najpopularniejszy wskaźnik to papierek uniwersalny, który w roztworach kwasowych staje się czerwony. Innym przykładem jest fenoloftaleina, która w roztworach kwasowych jest bezbarwna.
Rodzaje kwasów
Kwasy można podzielić na różne grupy, w zależności od ich budowy. Podstawowy podział to na kwasy beztlenowe i tlenowe. Zobaczmy, co to oznacza. Różnice są kluczowe dla zrozumienia ich właściwości.
Kwasy beztlenowe
Kwasy beztlenowe to kwasy, które w swojej cząsteczce zawierają wodór i niemetal, ale nie zawierają tlenu. Najbardziej znanym przykładem jest kwas solny (HCl). Używany jest m.in. do produkcji soli, a w naszym żołądku pomaga trawić pokarm.
Inne przykłady kwasów beztlenowych to kwas fluorowodorowy (HF) i kwas siarkowodorowy (H2S). Kwas fluorowodorowy jest bardzo agresywny i używany do trawienia szkła. Kwas siarkowodorowy ma charakterystyczny zapach zgniłych jaj.
Kwasy tlenowe
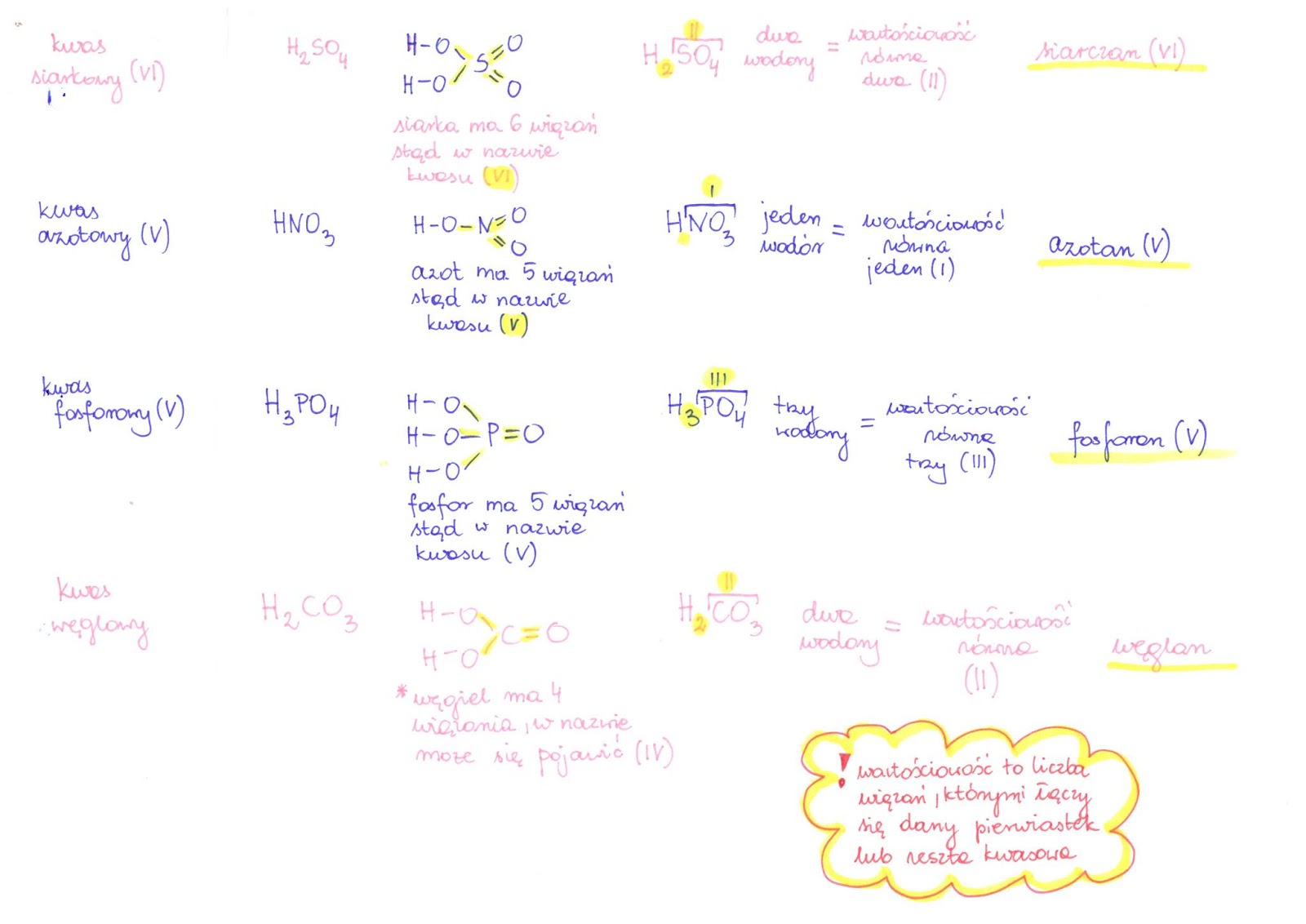
Kwasy tlenowe zawierają w swojej cząsteczce wodór, tlen i niemetal. Są one bardziej złożone niż kwasy beztlenowe. Przykładem jest kwas siarkowy(VI) (H2SO4), który jest jednym z najważniejszych kwasów w przemyśle.
Inne przykłady kwasów tlenowych to kwas azotowy(V) (HNO3) i kwas fosforowy(V) (H3PO4). Kwas azotowy jest używany do produkcji nawozów, a kwas fosforowy jest składnikiem nawozów i detergentów.
Reakcje kwasów
Kwasy wchodzą w różne reakcje chemiczne. Zrozumienie tych reakcji pomoże Ci rozwiązywać zadania na sprawdzianie. Spróbujemy omówić najważniejsze.
Reakcja kwasów z metalami
Jak wspomnieliśmy wcześniej, kwasy reagują z metalami, tworząc wodór i sól. Ogólny schemat tej reakcji wygląda następująco: Kwas + Metal → Sól + Wodór. Na przykład, reakcja kwasu solnego z cynkiem: 2HCl + Zn → ZnCl2 + H2.
Ważne jest, aby pamiętać, że nie wszystkie metale reagują z kwasami. Metale szlachetne, takie jak złoto i platyna, są odporne na działanie kwasów. Wynika to z ich niskiej aktywności chemicznej.
Reakcja kwasów z zasadami (neutralizacja)
Neutralizacja to reakcja kwasu z zasadą, w wyniku której powstaje sól i woda. Jest to jedna z najważniejszych reakcji w chemii. Ogólny schemat tej reakcji wygląda następująco: Kwas + Zasada → Sól + Woda.
Na przykład, reakcja kwasu solnego z wodorotlenkiem sodu: HCl + NaOH → NaCl + H2O. W tej reakcji kwas solny reaguje z zasadą sodową, tworząc sól kuchenną i wodę. Neutralizacja jest wykorzystywana w wielu procesach przemysłowych i laboratoryjnych.
Reakcja kwasów z tlenkami metali
Kwasy reagują również z tlenkami metali, tworząc sól i wodę. Ogólny schemat tej reakcji wygląda następująco: Kwas + Tlenek metalu → Sól + Woda. Na przykład, reakcja kwasu solnego z tlenkiem miedzi(II): 2HCl + CuO → CuCl2 + H2O.
W tej reakcji kwas solny reaguje z tlenkiem miedzi, tworząc chlorek miedzi(II) i wodę. Reakcje z tlenkami metali są ważne w procesach otrzymywania soli metali.
Skala pH
pH to miara kwasowości lub zasadowości roztworu. Skala pH ma zakres od 0 do 14. Roztwory o pH poniżej 7 są kwasowe, roztwory o pH powyżej 7 są zasadowe, a roztwory o pH równym 7 są obojętne.
Im niższe pH, tym roztwór jest bardziej kwaśny. Na przykład, roztwór o pH 1 jest bardzo kwaśny, a roztwór o pH 6 jest słabo kwaśny. Podobnie, im wyższe pH, tym roztwór jest bardziej zasadowy. Roztwór o pH 8 jest słabo zasadowy, a roztwór o pH 14 jest bardzo zasadowy.
Pamiętaj, że skala pH jest logarytmiczna. Oznacza to, że zmiana pH o jedną jednostkę odpowiada dziesięciokrotnej zmianie stężenia jonów wodorowych. Na przykład, roztwór o pH 3 jest dziesięć razy bardziej kwaśny niż roztwór o pH 4.
Kwasy w życiu codziennym
Kwasy są obecne w wielu aspektach naszego życia. Wiele produktów spożywczych, które spożywamy, zawiera kwasy. Zrozumienie ich roli pomoże ci lepiej przyswoić wiedzę.
Na przykład, kwas cytrynowy znajduje się w cytrynach i innych owocach cytrusowych. Używany jest jako dodatek do żywności i napojów. Kwas octowy, czyli ocet, jest używany do konserwowania żywności i jako przyprawa. Kwas mlekowy powstaje podczas fermentacji mlekowej i jest obecny w jogurtach i kiszonkach.
Kwasy są również używane w przemyśle. Kwas siarkowy(VI) jest używany do produkcji nawozów, detergentów i tworzyw sztucznych. Kwas solny jest używany do czyszczenia metali i w procesach przemysłowych. Warto znać te zastosowania!
Podsumowanie
Kwasy to związki chemiczne, które rozpuszczone w wodzie tworzą jony wodorowe. Mają kwaśny smak, reagują z metalami i zmieniają barwę wskaźników. Dzielimy je na kwasy beztlenowe i tlenowe. Wchodzą w reakcje z metalami, zasadami i tlenkami metali. Skala pH służy do określania kwasowości i zasadowości roztworów. Kwasy są obecne w wielu aspektach naszego życia, od żywności po przemysł. Pamiętaj o tych definicjach na sprawdzianie!
Mam nadzieję, że ten artykuł pomógł Ci zrozumieć kwasy i przygotować się do sprawdzianu z chemii. Powodzenia na sprawdzianie! Pamiętaj, że kluczem do sukcesu jest zrozumienie podstawowych pojęć i regularne powtarzanie materiału.