Hej Ósmoklasisto! Gotowy na sprawdzian z soli? Spokojnie, rozłożymy to na czynniki pierwsze. Będzie łatwo i przyjemnie. Obiecuję! Myśl o tym jak o układance, gdzie każdy element ma swoje miejsce.
Co to są Sole?
Wyobraź sobie sól kuchenną – NaCl. To najbardziej znana sól. Ale soli jest o wiele, wiele więcej!
Sole to związki chemiczne. Powstają, gdy kwas reaguje z zasadą lub metalem. Pomyśl o tym jak o połączeniu dwóch klocków LEGO. Jeden klocek to kwas, drugi to zasada, a po połączeniu mamy... sól!
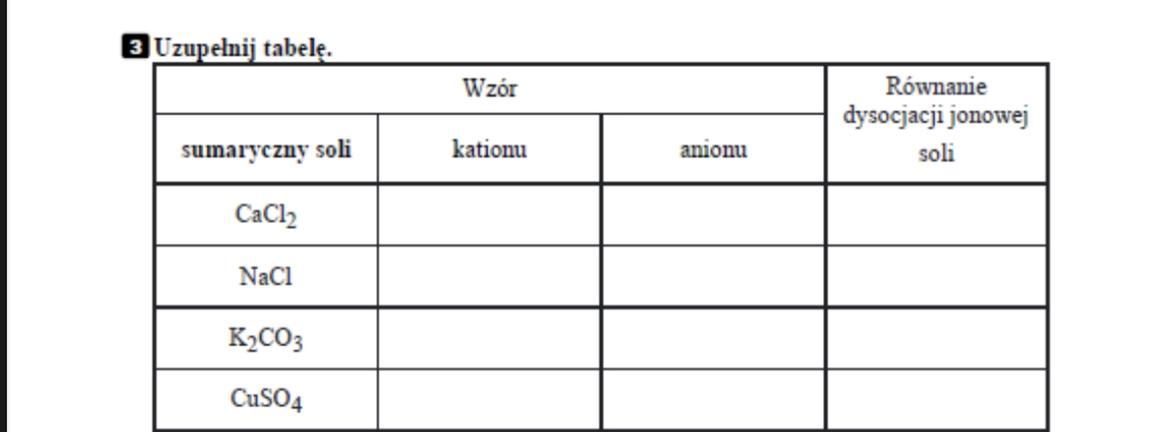
Sole składają się z kationu metalu (lub jonu amonowego, NH4+) i anionu reszty kwasowej. Kation to jon o ładunku dodatnim. Anion to jon o ładunku ujemnym. Jak magnes – plus i minus się przyciągają, tworząc stabilną całość.
Na przykład w NaCl, Na+ to kation sodu, a Cl- to anion chlorkowy.
Nazewnictwo Soli
Nazwy soli tworzymy od nazwy kwasu, od którego pochodzi reszta kwasowa. Dodajemy nazwę metalu (lub amonu).
Kwas solny (HCl) tworzy chlorki. Na przykład chlorek sodu (NaCl). Pamiętasz? Sól kuchenna!
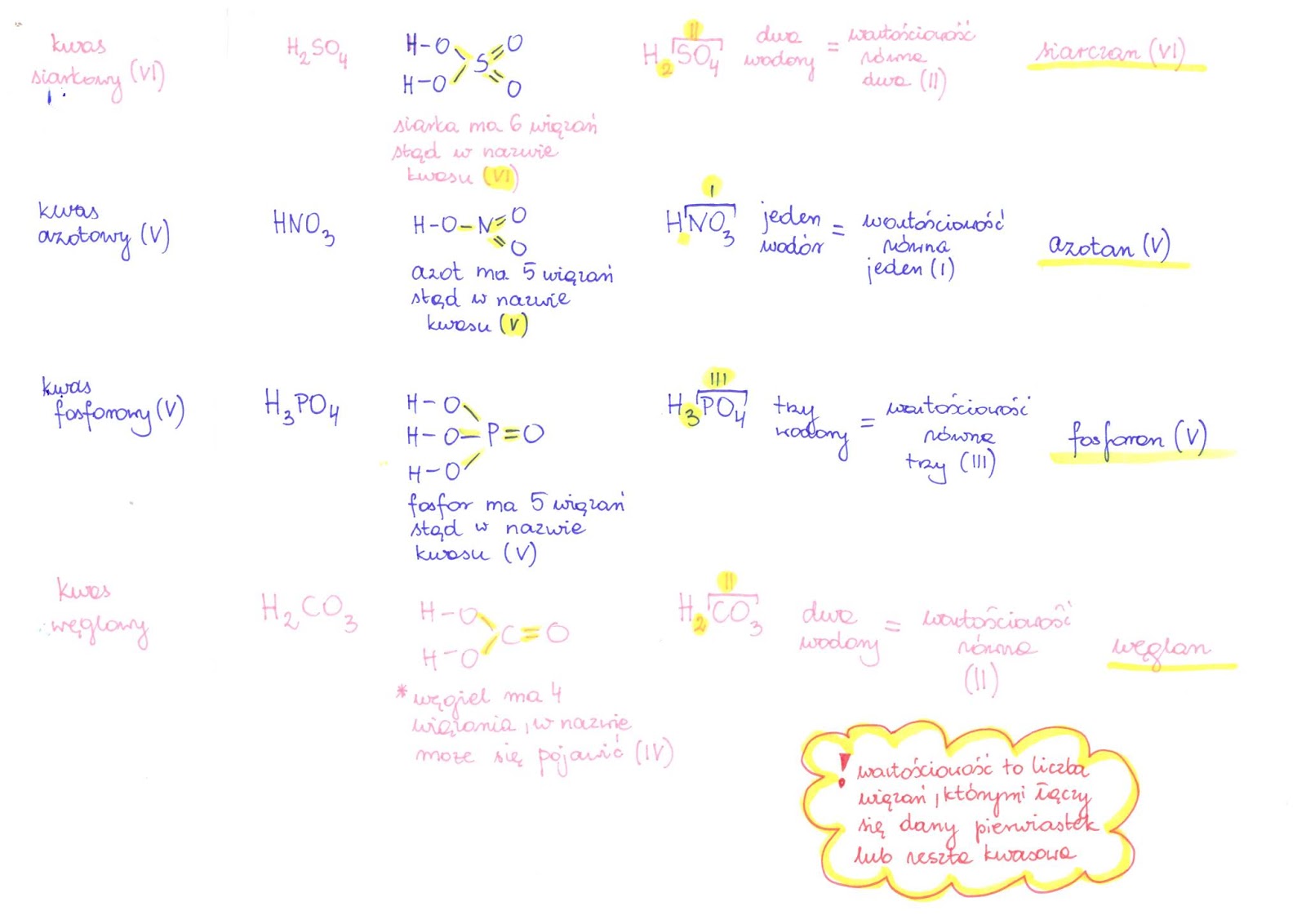
Kwas siarkowy(VI) (H2SO4) tworzy siarczany(VI). Na przykład siarczan(VI) miedzi(II) (CuSO4). Wyobraź sobie niebieskie kryształki! Używane w doświadczeniach chemicznych.
Kwas azotowy(V) (HNO3) tworzy azotany(V). Na przykład azotan(V) potasu (KNO3). Składnik nawozów sztucznych.
Reakcje Powstawania Soli
Sole powstają w różnych reakcjach. Najważniejsze to:
Reakcja Kwas + Zasada (Reakcja zobojętniania)
To tak jak gaszenie ognia. Kwas "pali", zasada "gasi". Po połączeniu zostaje sól i woda. Np.:
HCl + NaOH → NaCl + H2O
Kwas solny + Wodorotlenek sodu → Chlorek sodu + Woda
Reakcja Metal + Kwas
Metal reaguje z kwasem, tworząc sól i wodór (gaz). Pomyśl o tym jak o bombelkach wydobywających się z roztworu!
Zn + H2SO4 → ZnSO4 + H2↑
Cynk + Kwas siarkowy(VI) → Siarczan(VI) cynku + Wodór
Reakcja Tlenek metalu + Kwas
Tlenek metalu reaguje z kwasem, tworząc sól i wodę. Wyobraź sobie rdzę (tlenek żelaza) rozpuszczającą się w kwasie.
CuO + 2HCl → CuCl2 + H2O
Tlenek miedzi(II) + Kwas solny → Chlorek miedzi(II) + Woda
Reakcja Metal + Niemetal
To bezpośrednie połączenie. Np. spalanie magnezu w chlorze.
Mg + Cl2 → MgCl2
Magnez + Chlor → Chlorek magnezu
Właściwości Soli
Sole mają różne właściwości. Zależą one od tego, jakie jony je tworzą.
Większość soli to substancje krystaliczne. Widzisz te błyszczące kryształki soli kuchennej? To właśnie to!
Sole mają różne temperatury topnienia i wrzenia. Bardzo wysokie!
Wiele soli dobrze rozpuszcza się w wodzie. Pomyśl o soli kuchennej rozpuszczonej w zupie.
Roztwory soli przewodzą prąd elektryczny. Dlatego nie wolno używać urządzeń elektrycznych w wannie pełnej wody z solą!
Przykłady i Zastosowania Soli
Chlorek sodu (NaCl): Sól kuchenna! Używana do przyprawiania potraw, konserwowania żywności.
Węglan wapnia (CaCO3): Marmur, kreda! Używany w budownictwie, przemyśle papierniczym.
Siarczan(VI) wapnia (CaSO4): Gips! Używany w budownictwie, medycynie (gipsowe opatrunki).
Azotan(V) potasu (KNO3): Saletra potasowa! Używany jako nawóz, w produkcji prochu.
Węglan sodu (Na2CO3): Soda kalcynowana! Używany w produkcji szkła, mydła.
Rozpuszczalność Soli
Nie wszystkie sole dobrze rozpuszczają się w wodzie. Sprawdź tabelę rozpuszczalności soli! To twoja ściągawka na sprawdzianie!
Sole, które nie rozpuszczają się w wodzie, tworzą osad. Pomyśl o mące ziemniaczanej w wodzie – opada na dno.
Hydroliza Soli
Sole, które pochodzą od słabych kwasów lub słabych zasad, ulegają hydrolizie. Czyli reagują z wodą, zmieniając jej odczyn. To trochę bardziej zaawansowane, ale warto o tym wiedzieć!
Pamiętaj! Regularna nauka i zrozumienie podstaw to klucz do sukcesu. Powodzenia na sprawdzianie!