Witaj w artykule poświęconym solom, tematowi, który często pojawia się na sprawdzianach z chemii w klasie ósmej. Zajmiemy się definicją soli, ich nazewnictwem, właściwościami i sposobami otrzymywania. Przygotuj się na solidną dawkę wiedzy, która pomoże Ci zrozumieć ten ważny dział chemii!
Czym są Sole?
Sole to związki chemiczne, które powstają w wyniku reakcji kwasu z zasadą. Ta reakcja nazywana jest reakcją zobojętniania. Sole składają się z kationu metalu (lub kationu amonu, NH4+) i anionu pochodzącego od kwasu. Przykładem może być sól kuchenna, czyli chlorek sodu (NaCl), która powstaje w reakcji kwasu solnego (HCl) z wodorotlenkiem sodu (NaOH).
Sole są powszechne w naszym otoczeniu. Wiele z nich ma istotne zastosowania w przemyśle, rolnictwie i życiu codziennym. Ważne jest, aby zrozumieć ich właściwości i sposób powstawania, aby móc je odpowiednio wykorzystywać i bezpiecznie z nimi pracować. Sole są związkami jonowymi, co oznacza, że tworzą sieć krystaliczną zbudowaną z jonów.
Nazewnictwo Soli
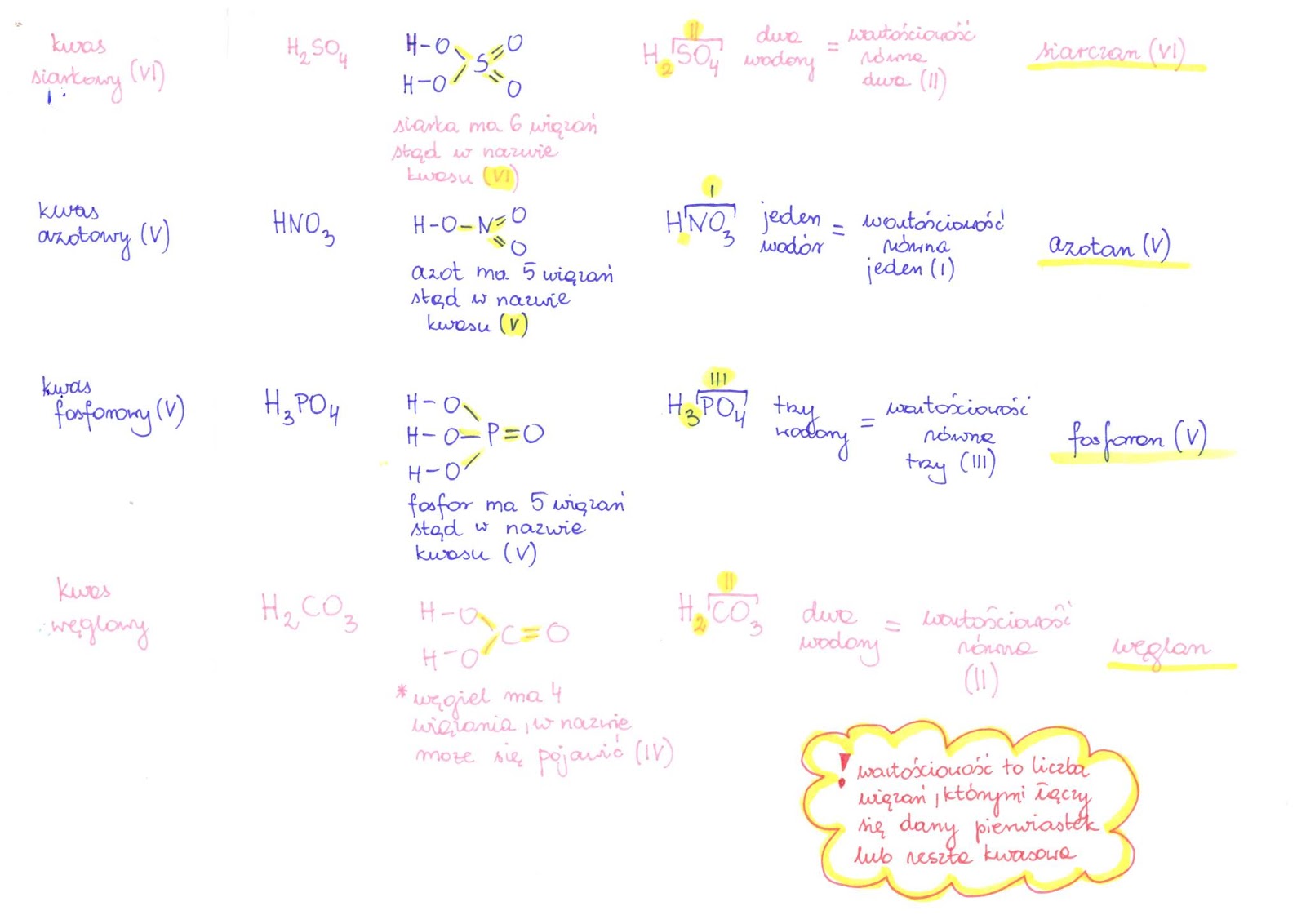
Nazwy soli tworzy się od nazwy kwasu, od którego pochodzi anion i nazwy metalu (kationu). Ważne jest, aby znać nazwy popularnych kwasów i odpowiadających im anionów, aby prawidłowo nazwać daną sól. Na przykład, kwas siarkowy (VI) (H2SO4) tworzy anion siarczanowy(VI) (SO42-), a kwas azotowy(V) (HNO3) tworzy anion azotanowy(V) (NO3-).
Jeśli metal występuje na różnych stopniach utlenienia, należy podać jego wartościowość w nazwie soli. Na przykład, chlorek żelaza(II) to FeCl2, a chlorek żelaza(III) to FeCl3. Zrozumienie stopni utlenienia metali jest kluczowe do poprawnego nazewnictwa soli. Pamiętaj, że wartościowość metalu w soli odpowiada ładunkowi jego jonu.
Przykłady: * NaCl – chlorek sodu (anion od kwasu solnego HCl) * CaCO3 – węglan wapnia (anion od kwasu węglowego H2CO3) * K2SO4 – siarczan(VI) potasu (anion od kwasu siarkowego(VI) H2SO4)
Otrzymywanie Soli
Istnieje kilka sposobów otrzymywania soli. Najpopularniejsze metody to:
* Reakcja kwasu z zasadą (zobojętnianie): To reakcja, w której kwas reaguje z zasadą, tworząc sól i wodę. Przykład: HCl + NaOH → NaCl + H2O. Ta metoda jest często używana do otrzymywania soli rozpuszczalnych w wodzie. * Reakcja metalu z kwasem: Niektóre metale reagują z kwasami, tworząc sól i wodór. Przykład: Zn + H2SO4 → ZnSO4 + H2↑. Ważne jest, aby pamiętać, że nie wszystkie metale reagują z kwasami. * Reakcja tlenku metalu z kwasem: Tlenki metali reagują z kwasami, tworząc sól i wodę. Przykład: CuO + 2HCl → CuCl2 + H2O. Ta metoda jest szczególnie przydatna do otrzymywania soli metali przejściowych. * Reakcja metalu z niemetalem: Niektóre metale reagują bezpośrednio z niemetalami, tworząc sól. Przykład: 2Na + Cl2 → 2NaCl. Ta metoda jest wykorzystywana do otrzymywania soli, w których niemetal ma silne właściwości utleniające. * Reakcja soli z kwasem (strącanie osadów): Ta metoda polega na dodaniu kwasu do roztworu soli, w wyniku czego powstaje nowa sól i osad. Przykład: BaCl2 + H2SO4 -> BaSO4↓ + 2HCl. Strącanie osadów jest użyteczne do oddzielania soli o różnych rozpuszczalnościach.Właściwości Soli
Sole mają różne właściwości fizyczne i chemiczne. Wiele z nich to substancje krystaliczne o wysokich temperaturach topnienia i wrzenia. Często są dobrze rozpuszczalne w wodzie, ale istnieją również sole trudno rozpuszczalne. Rozpuszczalność soli zależy od rodzaju kationu i anionu, z których są zbudowane, oraz od temperatury.
Rozpuszczalność soli jest ważna w wielu procesach chemicznych i przemysłowych. W niektórych przypadkach, sole w roztworach wodnych ulegają dysocjacji jonowej, czyli rozpadają się na jony. Roztwory soli mogą przewodzić prąd elektryczny, ponieważ zawierają swobodne jony. Właściwość ta wykorzystywana jest w elektrolizie.
Właściwości chemiczne soli zależą od ich składu. Niektóre sole reagują z innymi substancjami, tworząc nowe związki. Na przykład, niektóre sole reagują z kwasami lub zasadami, uwalniając gazy lub tworząc osady. Znajomość właściwości soli jest kluczowa do przewidywania ich zachowania w różnych reakcjach chemicznych.
Przykłady i Zastosowania Soli
Sole mają szerokie zastosowanie w różnych dziedzinach. Oto kilka przykładów:
* Chlorek sodu (NaCl) – sól kuchenna, stosowana w kuchni, przemyśle spożywczym i chemicznym. Jest niezbędna do życia wielu organizmów. * Węglan wapnia (CaCO3) – składnik skał wapiennych, kredy, marmuru, stosowany w budownictwie, przemyśle cementowym i farmaceutycznym. Jest używany do produkcji wapna palonego. * Siarczan(VI) wapnia (CaSO4) – gips, stosowany w budownictwie, medycynie (opatrunki gipsowe) i rzeźbiarstwie. * Azotan(V) potasu (KNO3) – saletra potasowa, stosowana jako nawóz, składnik prochu czarnego i w przemyśle spożywczym. * Węglan sodu (Na2CO3) – soda kalcynowana, stosowana w przemyśle szklarskim, chemicznym i papierniczym.Podsumowanie
Sole to ważne związki chemiczne, które warto dobrze poznać. Pamiętaj o ich definicji, nazewnictwie, sposobach otrzymywania i właściwościach. Zrozumienie tych zagadnień pomoże Ci nie tylko na sprawdzianach z chemii, ale również w dalszej edukacji chemicznej. Regularne powtarzanie materiału i rozwiązywanie zadań to klucz do sukcesu. Powodzenia!