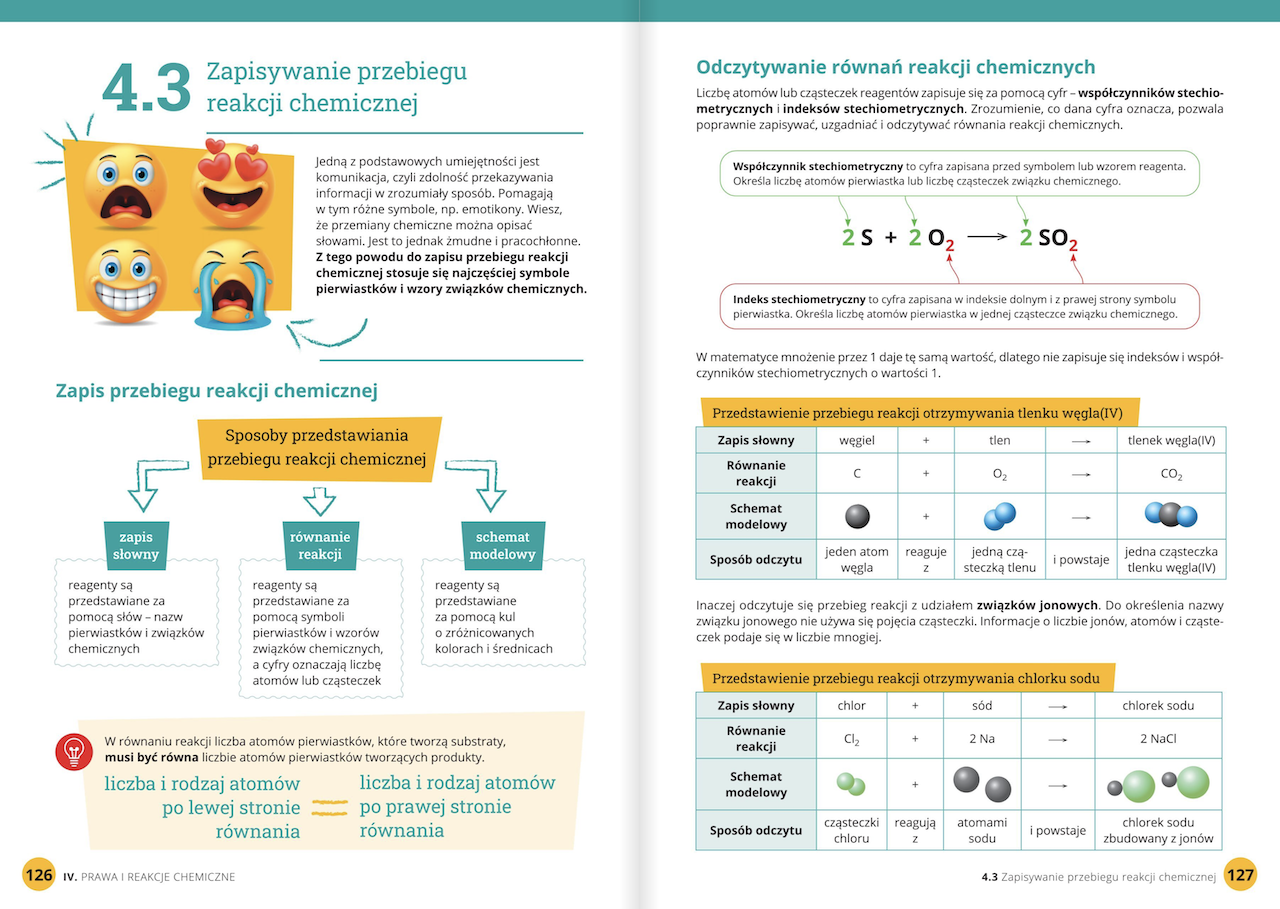
Hej siódmoklasiści! Przygotowujemy się razem do sprawdzianu z chemii, dział II. Nie martwcie się, damy radę! Pamiętajcie, że kluczem jest zrozumienie, a nie tylko wkuwanie. Skupimy się na najważniejszych zagadnieniach, abyście czuli się pewnie i gotowi na wszystko. Powodzenia!
Substancje i ich właściwości
Zacznijmy od podstaw. Musimy dobrze rozumieć, czym jest substancja. Pamiętajcie, że substancja to materiał, z którego zbudowane są wszystkie ciała. Każda substancja ma swoje unikalne właściwości, które pozwalają nam ją rozpoznać i odróżnić od innych. Te właściwości dzielimy na fizyczne i chemiczne.
Właściwości fizyczne
Właściwości fizyczne to cechy, które możemy zaobserwować lub zmierzyć bez zmiany składu chemicznego substancji. Należą do nich:
- Stan skupienia: czyli czy dana substancja jest ciałem stałym, cieczą czy gazem (np. lód, woda, para wodna).
- Barwa: kolor substancji (np. siarka jest żółta).
- Zapach: charakterystyczna woń (np. ocet ma ostry zapach).
- Gęstość: masa substancji na jednostkę objętości (np. żelazo jest gęstsze od drewna).
- Temperatura wrzenia: temperatura, w której ciecz zaczyna wrzeć i przechodzi w stan gazowy (np. woda wrze w temperaturze 100°C).
- Temperatura topnienia: temperatura, w której ciało stałe zaczyna się topić i przechodzi w stan ciekły (np. lód topi się w temperaturze 0°C).
- Rozpuszczalność: zdolność substancji do rozpuszczania się w innej (np. cukier rozpuszcza się w wodzie).
- Przewodnictwo elektryczne i cieplne: zdolność substancji do przewodzenia prądu elektrycznego i ciepła (np. metale dobrze przewodzą prąd i ciepło).
Spróbujcie sobie przypomnieć przykłady różnych substancji i ich właściwości fizycznych. To pomoże Wam zrozumieć, jak je identyfikować.
Właściwości chemiczne
Właściwości chemiczne opisują, jak dana substancja reaguje z innymi substancjami, czyli jak zmienia się jej skład chemiczny. Przykłady to:
- Palność: zdolność substancji do spalania się (np. drewno jest palne, a żelazo nie).
- Reaktywność: skłonność substancji do wchodzenia w reakcje chemiczne (np. sód bardzo łatwo reaguje z wodą).
- Toksyczność: szkodliwość substancji dla organizmów żywych (np. niektóre metale ciężkie są toksyczne).
- Korozyjność: zdolność substancji do niszczenia innych materiałów (np. kwas solny koroduje metale).
Pamiętajcie, że obserwacja właściwości chemicznych wymaga przeprowadzenia reakcji chemicznej.
Mieszaniny
Mieszanina to połączenie dwóch lub więcej substancji, które nie reagują ze sobą chemicznie. Oznacza to, że każda z substancji zachowuje swoje właściwości. Mieszaniny dzielimy na jednorodne i różnorodne.
Mieszaniny jednorodne
W mieszaninach jednorodnych nie widać gołym okiem ani pod mikroskopem składników, z których są zbudowane. Składniki są równomiernie rozmieszczone. Przykładami są:
- Powietrze: mieszanina azotu, tlenu i innych gazów.
- Woda z solą: sól rozpuszcza się w wodzie i nie widać jej oddzielnie.
- Ocet: roztwór kwasu octowego w wodzie.
Mieszaniny różnorodne
W mieszaninach różnorodnych można gołym okiem lub pod mikroskopem rozróżnić składniki, z których są zbudowane. Składniki nie są równomiernie rozmieszczone. Przykłady to:
- Piasek z wodą: piasek osiada na dnie i widać go oddzielnie.
- Zupa jarzynowa: widać kawałki warzyw.
- Mleko: zawiera zawieszone cząsteczki tłuszczu. (Może być traktowane jako przykład mieszaniny koloidalnej, ale dla uproszczenia w klasie 7 można je traktować jako różnorodną.)
Metody rozdzielania mieszanin
Skoro mieszaniny to połączenia substancji, które nie reagują ze sobą chemicznie, możemy je rozdzielać na poszczególne składniki. Istnieje wiele metod rozdzielania, a wybór zależy od rodzaju mieszaniny.
Sączenie (Filtracja)
Sączenie to metoda rozdzielania mieszanin ciała stałego i cieczy, w której ciało stałe jest nierozpuszczalne w cieczy. Wykorzystujemy filtr, który zatrzymuje ciało stałe (osad), a przepuszcza ciecz (przesącz). Przykład: rozdzielanie piasku od wody.
Dekantacja (Zlewanie)
Dekantacja polega na ostrożnym zlewaniu cieczy znad osadu, który osiadł na dnie naczynia. Jest to prosta metoda, ale nie pozwala na dokładne rozdzielenie składników. Przykład: oddzielanie wina od osadu.
Odparowywanie
Odparowywanie polega na ogrzewaniu mieszaniny, aby ciecz przeszła w stan gazowy, a ciało stałe pozostało na dnie naczynia. Metoda ta jest szczególnie przydatna, gdy chcemy odzyskać ciało stałe. Przykład: odzyskiwanie soli z roztworu wody z solą.
Destylacja
Destylacja to metoda rozdzielania mieszanin cieczy, które różnią się temperaturami wrzenia. Ogrzewamy mieszaninę, a ciecz o niższej temperaturze wrzenia odparowuje jako pierwsza. Następnie pary są schładzane i skraplane, dzięki czemu oddzielamy poszczególne składniki. Przykład: rozdzielanie wody i alkoholu.
Rozdzielanie magnetyczne
Rozdzielanie magnetyczne wykorzystuje właściwości magnetyczne substancji. Jeśli jeden ze składników mieszaniny jest przyciągany przez magnes, możemy go oddzielić od pozostałych składników. Przykład: oddzielanie opiłków żelaza od piasku.
Podsumowanie
To był intensywny przegląd materiału! Pamiętajcie o najważniejszych pojęciach:
- Substancja i jej właściwości (fizyczne i chemiczne).
- Mieszaniny jednorodne i różnorodne.
- Metody rozdzielania mieszanin: sączenie, dekantacja, odparowywanie, destylacja, rozdzielanie magnetyczne.
Przed sprawdzianem postarajcie się rozwiązać jak najwięcej zadań i powtórzyć materiał. Jeśli macie pytania, nie wahajcie się zapytać! Wierzę w Was! Powodzenia!