Witaj w czwartym dziale chemii dla klasy siódmej! W tym dziale skupimy się na niezwykle ważnych zagadnieniach związanych z reakcjami chemicznymi. Nauczymy się, czym są reakcje chemiczne, jak je zapisywać i jak je klasyfikować. Przygotuj się na fascynującą podróż po świecie zmian chemicznych!
Czym są reakcje chemiczne?
Reakcja chemiczna to proces, w którym dochodzi do przekształcenia jednych substancji w inne. Substancje, które biorą udział w reakcji nazywamy substratami, a substancje, które powstają w wyniku reakcji nazywamy produktami. Wyobraź sobie, że masz ciasto (substrat). Pieczenie to reakcja chemiczna, która przekształca to ciasto w pyszny, upieczony tort (produkt). Inny przykład: drewno (substrat) spalone w kominku daje popiół, dwutlenek węgla i inne gazy (produkty).
Podczas reakcji chemicznych dochodzi do zrywania starych i tworzenia nowych wiązań chemicznych między atomami. Atomy same w sobie nie znikają ani nie pojawiają się – po prostu łączą się ze sobą w inny sposób. To bardzo ważne – ilość atomów każdego pierwiastka musi być taka sama przed reakcją (w substratach) i po reakcji (w produktach). Tę zasadę nazywamy prawem zachowania masy.
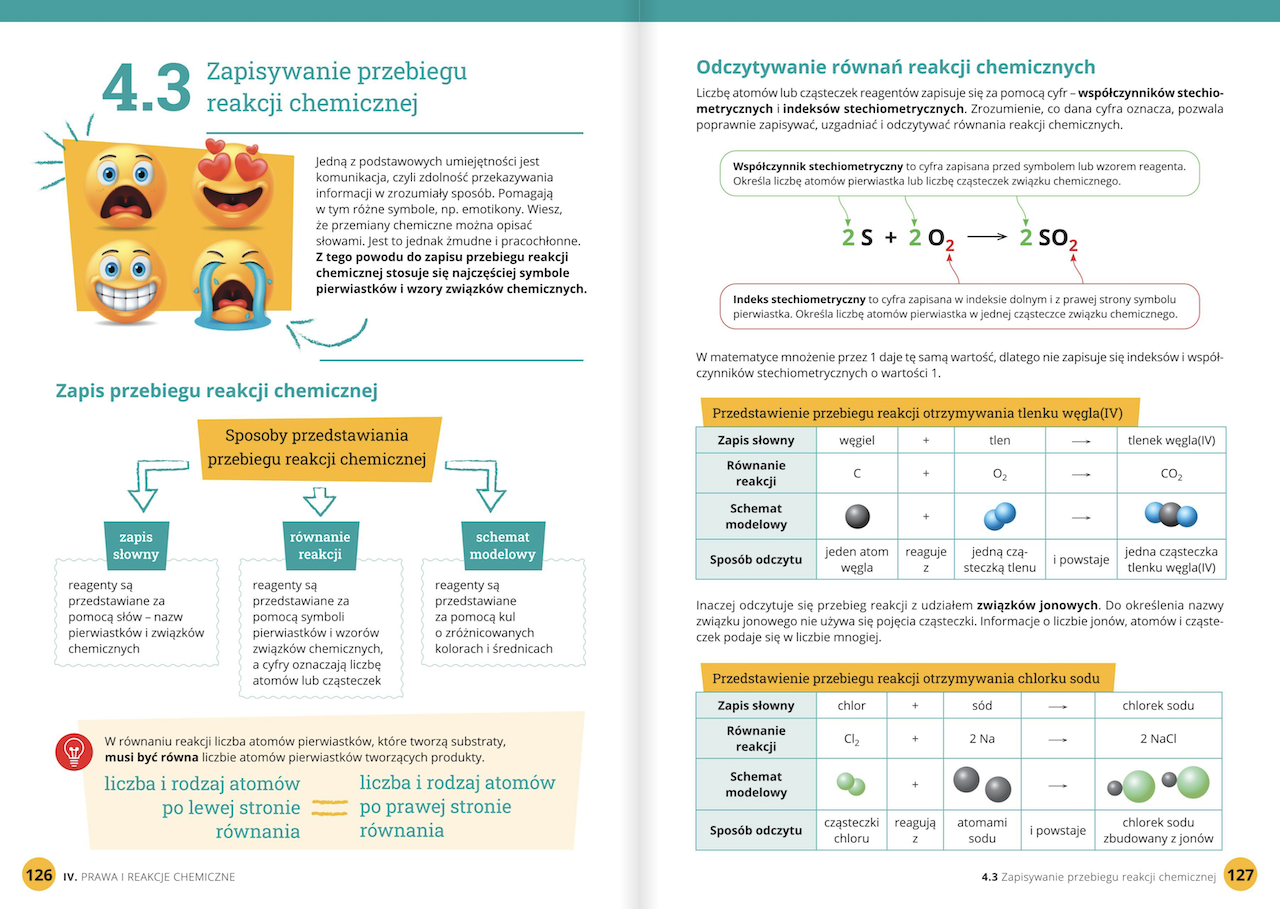
Reakcję chemiczną możemy zapisać za pomocą równania reakcji chemicznej. Na przykład, reakcję łączenia się wodoru z tlenem, tworząc wodę, możemy zapisać tak:
2 H2 + O2 → 2 H2O
Co to oznacza? 2 cząsteczki wodoru (H2) reagują z 1 cząsteczką tlenu (O2), dając 2 cząsteczki wody (H2O). Cyfry przed wzorami chemicznymi (np. 2 przed H2) nazywamy współczynnikami stechiometrycznymi. Służą one do uzgadniania równania reakcji, czyli dopilnowania, żeby ilość atomów każdego pierwiastka była taka sama po obu stronach równania. Strzałka (→) oznacza kierunek reakcji – od substratów do produktów.
Rodzaje reakcji chemicznych
Istnieje wiele różnych rodzajów reakcji chemicznych. Poznamy teraz kilka podstawowych:
1. Reakcja syntezy (łączenia)
W reakcji syntezy dwie lub więcej substancji łączy się, tworząc jedną, bardziej złożoną substancję. Możemy to zapisać ogólnie jako:
A + B → AB
Przykład: połączenie żelaza (Fe) z siarką (S) daje siarczek żelaza(II) (FeS):
Fe + S → FeS
2. Reakcja analizy (rozkładu)
W reakcji analizy jedna, bardziej złożona substancja rozkłada się na dwie lub więcej prostszych substancji. Możemy to zapisać ogólnie jako:
AB → A + B
Przykład: rozkład wody (H2O) na wodór (H2) i tlen (O2) (proces elektrolizy):
2 H2O → 2 H2 + O2
3. Reakcja wymiany
W reakcji wymiany jeden atom lub grupa atomów z jednej substancji jest zamieniana na inny atom lub grupę atomów z innej substancji. Wyróżniamy dwa główne typy reakcji wymiany:
- Reakcja pojedynczej wymiany: Atom jednego pierwiastka wypiera atom innego pierwiastka z związku chemicznego. A + BC → AC + B Przykład: Cynk (Zn) wypiera miedź (Cu) z roztworu siarczanu miedzi(II) (CuSO4): Zn + CuSO4 → ZnSO4 + Cu
- Reakcja podwójnej wymiany: Dwa związki wymieniają się swoimi jonami. AB + CD → AD + CB Przykład: reakcja roztworu azotanu srebra (AgNO3) z roztworem chlorku sodu (NaCl) prowadzi do powstania osadu chlorku srebra (AgCl) i roztworu azotanu sodu (NaNO3): AgNO3 + NaCl → AgCl + NaNO3
Czynniki wpływające na szybkość reakcji chemicznych
Szybkość reakcji chemicznej to miara tego, jak szybko substraty przekształcają się w produkty. Istnieje kilka czynników, które mogą wpływać na szybkość reakcji:
- Stężenie substratów: Zazwyczaj, im wyższe stężenie substratów, tym szybsza reakcja. Dzieje się tak dlatego, że im więcej cząsteczek substratów znajduje się w danym obszarze, tym większe prawdopodobieństwo, że się zderzą i zareagują ze sobą.
- Temperatura: Zazwyczaj, im wyższa temperatura, tym szybsza reakcja. Wyższa temperatura oznacza, że cząsteczki mają więcej energii kinetycznej i częściej zderzają się ze sobą z odpowiednią energią, co prowadzi do zerwania wiązań i utworzenia nowych.
- Powierzchnia kontaktu: Jeśli substraty są w postaci stałej, szybkość reakcji zależy od powierzchni kontaktu. Im większa powierzchnia kontaktu, tym szybsza reakcja. Dlatego łatwiej jest spalić trociny niż duży kawałek drewna.
- Katalizatory: Katalizator to substancja, która przyspiesza reakcję chemiczną, nie ulegając przy tym trwałej zmianie. Katalizatory obniżają energię aktywacji reakcji, czyli energię potrzebną do rozpoczęcia reakcji.
Na przykład, enzymy w naszym ciele są katalizatorami biologicznymi, które przyspieszają reakcje chemiczne niezbędne do życia. Bez nich wiele z tych reakcji zachodziłoby zbyt wolno, abyśmy mogli funkcjonować.
Znaczenie reakcji chemicznych
Reakcje chemiczne są wszechobecne i mają ogromne znaczenie dla naszego życia. Odpowiadają za:
- Procesy życiowe: Oddychanie, trawienie, fotosynteza – to wszystko reakcje chemiczne.
- Produkcję materiałów: Produkcja leków, tworzyw sztucznych, nawozów, kosmetyków – to wszystko opiera się na reakcjach chemicznych.
- Energię: Spalanie paliw (np. węgla, ropy naftowej, gazu ziemnego) w elektrowniach, działanie baterii – to wszystko reakcje chemiczne dostarczające energii.
- Ochronę środowiska: Oczyszczanie ścieków, neutralizacja zanieczyszczeń – to również wykorzystuje reakcje chemiczne.
Zrozumienie reakcji chemicznych pozwala nam projektować nowe materiały, opracowywać nowe technologie i rozwiązywać problemy związane z ochroną środowiska. To niezwykle ważna dziedzina nauki, która ma ogromny wpływ na nasze życie!
Mam nadzieję, że ten artykuł pomógł Ci zrozumieć podstawy reakcji chemicznych. Pamiętaj, chemia jest wszędzie wokół nas! Powodzenia w dalszej nauce!