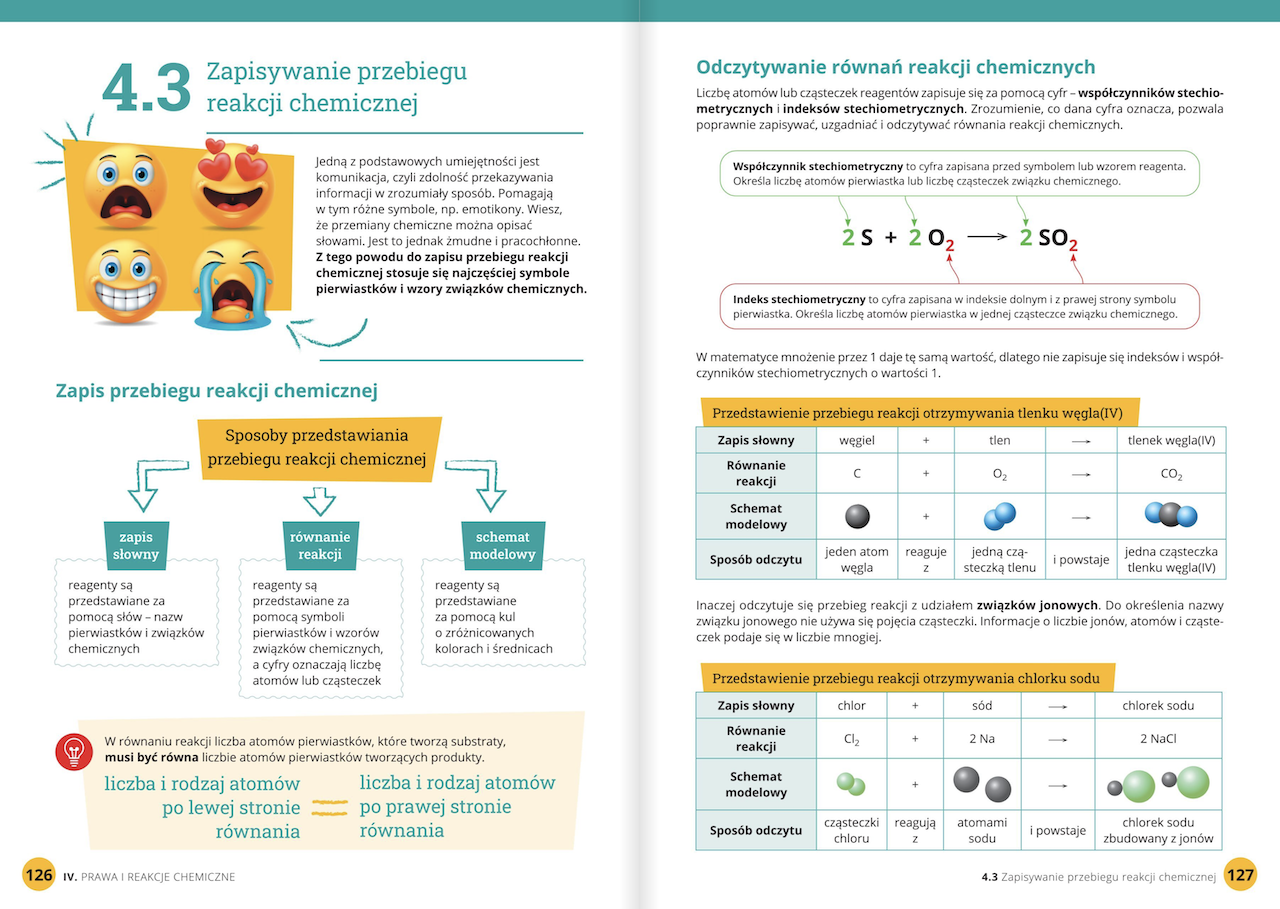
Witajcie, drodzy uczniowie! Gotowi na kolejną porcję wiedzy z chemii? Dziś zajmiemy się tematem Chemia Klasa 7 Dział 2. Zobaczycie, że chemia wcale nie jest taka straszna, jak ją malują! Postaramy się wszystko wytłumaczyć krok po kroku, używając prostego języka i przykładów z życia codziennego.
Substancje i Mieszaniny
Zacznijmy od podstaw: czym w ogóle są substancje? Najprościej mówiąc, to materiały o określonych właściwościach, z których zbudowany jest cały świat. Przykład? Woda (H₂O), sól kuchenna (NaCl) czy cukier (C₁₂H₂₂O₁₁). Każda z tych substancji ma swoje unikalne cechy, jak temperatura wrzenia, temperatura topnienia czy gęstość.
Teraz przejdźmy do mieszanin. Mieszanina to nic innego jak połączenie dwóch lub więcej substancji, które nie wchodzą ze sobą w reakcje chemiczne. Oznacza to, że każda substancja w mieszaninie zachowuje swoje właściwości. Wyobraźcie sobie miskę z owocami: mamy jabłka, banany, gruszki – każda z tych substancji (owoców) nadal jest jabłkiem, bananem i gruszką, mimo że znajdują się razem w misce. To jest właśnie mieszanina!
Mieszaniny dzielimy na dwa podstawowe rodzaje: mieszaniny jednorodne i mieszaniny niejednorodne.
Mieszaniny Jednorodne
Mieszanina jednorodna, zwana też roztworem, to taka mieszanina, w której nie jesteśmy w stanie gołym okiem (lub nawet pod mikroskopem) odróżnić poszczególnych składników. Wszystko wygląda jak jedna, spójna całość. Przykład? Weźmy wodę z cukrem. Po rozpuszczeniu cukru w wodzie nie widzimy już oddzielnych kryształków cukru. Mamy słodką wodę, która wygląda jednolicie. Inny przykład to powietrze – mieszanina gazów (azotu, tlenu i innych), która na pierwszy rzut oka wydaje się być jedną substancją.
Mieszaniny Niejednorodne
Z mieszaniną niejednorodną sprawa jest prosta: bez problemu możemy zobaczyć, co się na nią składa. Tutaj przykładem może być wspomniana miska owoców, ale także piasek z wodą, zupa z makaronem i warzywami czy sałatka. W każdym z tych przypadków wyraźnie widzimy poszczególne składniki.
Metody Rozdzielania Mieszanin
Skoro już wiemy, czym są mieszaniny, to warto nauczyć się, jak je rozdzielać na poszczególne składniki. Istnieje wiele metod, a wybór zależy od rodzaju mieszaniny i właściwości składników. Oto kilka najpopularniejszych:
- Dekantacja: To oddzielanie cieczy od osadu. Wyobraźcie sobie, że macie wodę z piaskiem. Piasek opadnie na dno. Ostrożnie zlewamy wodę, zostawiając piasek na dnie naczynia. To właśnie dekantacja!
- Sączenie (filtracja): Używamy filtra, aby oddzielić substancje stałe od cieczy. Przykład? Parzenie kawy. Fusy zostają na filtrze, a do filiżanki spływa aromatyczny napój.
- Odparowywanie: To oddzielanie substancji rozpuszczonej w cieczy poprzez jej odparowanie. Wyobraźcie sobie, że chcecie odzyskać sól z wody morskiej. Wystawiacie wodę na słońce, woda odparowuje, a na dnie zostaje sól.
- Destylacja: To metoda rozdzielania cieczy o różnych temperaturach wrzenia. Wyobraźcie sobie proces produkcji alkoholu. Najpierw fermentuje się zacier, a następnie podgrzewa. Alkohol ma niższą temperaturę wrzenia niż woda, więc pierwszy odparowuje. Następnie pary alkoholu są skraplane i zbierane.
- Rozdzielność magnetyczna: Ta metoda jest przydatna, gdy jeden ze składników mieszaniny ma właściwości magnetyczne. Na przykład, jeśli mamy mieszaninę piasku i opiłków żelaza, wystarczy użyć magnesu, aby oddzielić żelazo.
- Chromatografia: To zaawansowana metoda, która pozwala rozdzielać bardzo skomplikowane mieszaniny, na przykład barwniki. W tej metodzie wykorzystuje się różnice w powinowactwie substancji do fazy stacjonarnej i ruchomej.
Roztwory
Wróćmy na chwilę do roztworów. Roztwór składa się z rozpuszczalnika i substancji rozpuszczonej. Rozpuszczalnik to substancja, w której rozpuszcza się inna substancja (substancja rozpuszczona). Najczęściej używanym rozpuszczalnikiem jest woda, ale mogą być też inne ciecze, np. alkohol czy aceton.
Stężenie roztworu to ilość substancji rozpuszczonej w określonej ilości rozpuszczalnika lub roztworu. Możemy je wyrażać na różne sposoby, np. jako stężenie procentowe (ile gramów substancji znajduje się w 100 gramach roztworu) lub stężenie molowe (ile moli substancji znajduje się w 1 litrze roztworu). Na razie skupmy się na stężeniu procentowym, bo jest najłatwiejsze do zrozumienia.
Przykład: Jeśli mamy roztwór 10% cukru w wodzie, to oznacza, że w 100 gramach tego roztworu znajduje się 10 gramów cukru i 90 gramów wody.
Zjawiska Fizyczne i Reakcje Chemiczne
Na koniec porozmawiajmy o zjawiskach fizycznych i reakcjach chemicznych. To bardzo ważne pojęcia, które pomogą Wam zrozumieć, co się dzieje wokół nas.
Zjawisko fizyczne to zmiana stanu skupienia, kształtu lub objętości substancji, ale bez zmiany jej składu chemicznego. Przykład? Topnienie lodu. Lód to woda w stanie stałym, a po stopnieniu mamy wodę w stanie ciekłym. Nadal mamy wodę (H₂O), tylko w innej formie. Inne przykłady to krzepnięcie wody, parowanie, kondensacja, rozpuszczanie cukru w wodzie (bo cukier nie zmienia się w inną substancję, tylko rozprasza się w wodzie) i mieszanie różnych substancji, jeśli nie reagują ze sobą.
Reakcja chemiczna to proces, w którym zmienia się skład chemiczny substancji, tworząc nowe substancje o innych właściwościach. Przykład? Spalanie drewna. Drewno (głównie celuloza) reaguje z tlenem z powietrza, tworząc dwutlenek węgla, wodę i popiół. Substancje, które reagują ze sobą (drewno i tlen), nazywamy substratami, a substancje, które powstają w wyniku reakcji (dwutlenek węgla, woda i popiół), nazywamy produktami. Inne przykłady reakcji chemicznych to rdzewienie żelaza (żelazo reaguje z tlenem i wodą, tworząc rdzę), gotowanie jajka (białko zmienia swoją strukturę pod wpływem ciepła), pieczenie ciasta (składniki reagują ze sobą pod wpływem temperatury) i neutralizacja kwasu zasadą.
Rozpoznawanie reakcji chemicznych często wiąże się z obserwacją pewnych objawów, takich jak zmiana barwy, wydzielanie gazu, wydzielanie lub pochłanianie ciepła (reakcje egzotermiczne i endotermiczne) oraz powstawanie osadu.
Mam nadzieję, że ten artykuł pomógł Wam zrozumieć podstawy chemii z działu 2 klasy 7. Pamiętajcie, że kluczem do sukcesu jest regularna nauka i rozwiązywanie zadań. Powodzenia!