Drugi rok gimnazjum to kluczowy moment na wprowadzenie uczniów w świat kwasów. Solidne zrozumienie podstaw pozwoli im na dalszą naukę chemii.
Czym są kwasy? Wyjaśnienie koncepcji
Zacznijmy od definicji. Kwasy to substancje chemiczne, które w roztworze wodnym dysocjują na kation wodorowy (H+) oraz anion reszty kwasowej. Wyjaśnijmy, że to właśnie obecność jonów H+ odpowiada za charakterystyczne właściwości kwasów. Porównajmy to do prostego przykładu, np. soli kuchennej (NaCl) dysocjującej na jony Na+ i Cl-, ale w jej przypadku nie obserwujemy właściwości kwasowych.
Omówmy wskaźniki kwasowo-zasadowe. Użyjmy lakmusu (czerwienieje w kwasach), oranżu metylowego (czerwienieje w kwasach) i fenoloftaleiny (bezbarwna w kwasach). Pokażmy na przykładach jak zmieniają barwę w obecności różnych kwasów. Ważne jest, aby uczniowie zapamiętali, które wskaźniki są przydatne do identyfikacji kwasów.
Przykłady kwasów i ich zastosowania
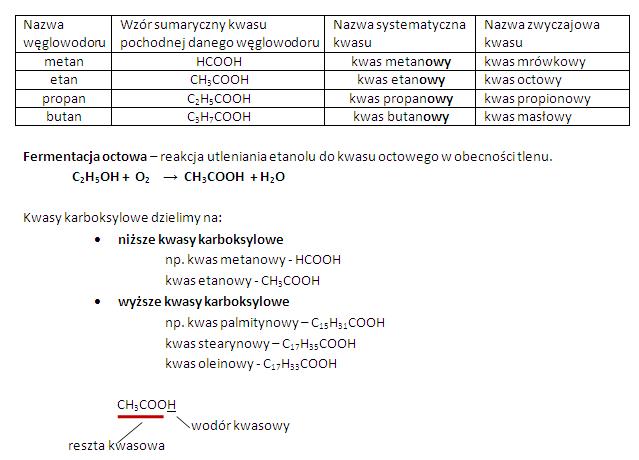
Wymieńmy kilka powszechnie znanych kwasów. Na przykład kwas solny (HCl), który jest obecny w żołądku i pomaga trawić pokarm. Kwas siarkowy (H2SO4), wykorzystywany w przemyśle i akumulatorach. Kwas azotowy (HNO3), stosowany w produkcji nawozów. Kwas octowy (CH3COOH), czyli popularny ocet, używany w kuchni. Pokażmy, że kwasy mają różnorodne zastosowania w życiu codziennym i przemyśle.
Wyjaśnijmy, co to są kwasy beztlenowe (np. HCl, HBr) i kwasy tlenowe (np. H2SO4, HNO3). Wytłumaczmy, że podział ten zależy od obecności atomów tlenu w cząsteczce kwasu. Można to przedstawić za pomocą prostych schematów graficznych.
Jak uczyć o reakcjach kwasów?
Podkreślmy, że kwasy reagują z metalami. Pokażmy reakcję kwasu solnego z magnezem (Mg + 2HCl → MgCl2 + H2). Oczywiście, nie wszystkie metale reagują z kwasami. Wyjaśnijmy pojęcie szeregu aktywności metali. Te bardziej aktywne (np. potas, sód, magnez) wypierają wodór z kwasów. Te mniej aktywne (np. miedź, srebro, złoto) nie reagują.
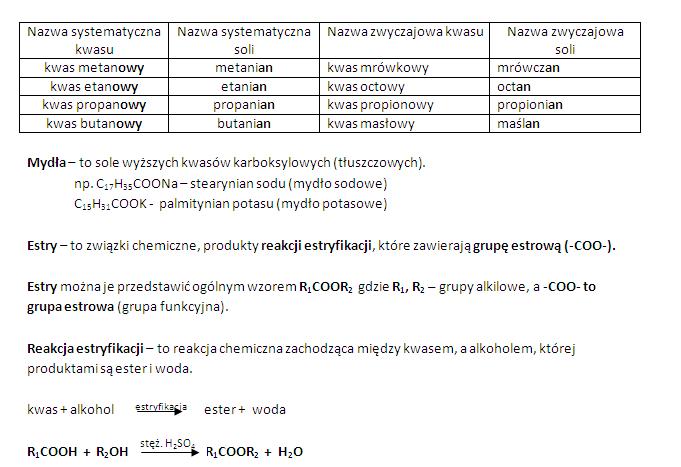
Kwasy reagują z tlenkami metali. Przykładowo reakcja kwasu solnego z tlenkiem magnezu (MgO + 2HCl → MgCl2 + H2O). Wyjaśnijmy, że w wyniku tej reakcji powstaje sól i woda. Reakcja ta jest przykładem reakcji zobojętniania.
Kwasy reagują z zasadami. To kolejna reakcja zobojętniania (np. HCl + NaOH → NaCl + H2O). W wyniku reakcji kwasu z zasadą powstaje sól i woda. Wyjaśnijmy, że reakcja zobojętniania prowadzi do zmniejszenia kwasowości i zasadowości roztworu.
Kwasy reagują z solami. Nie każda reakcja zajdzie. Zajdzie ona, gdy powstanie osad, gaz lub słaby kwas. Np. reakcja kwasu solnego z węglanem wapnia (CaCO3 + 2HCl → CaCl2 + H2O + CO2). Efektem jest wydzielanie się gazu – dwutlenku węgla.
Przykładowy sprawdzian – jak go przygotować?
Sprawdzian powinien sprawdzać zrozumienie podstawowych pojęć. Powinien obejmować: definicję kwasów, wskaźniki kwasowo-zasadowe, nazewnictwo kwasów, reakcje kwasów z metalami, tlenkami metali, zasadami i solami. Dodajmy zadania obliczeniowe, np. obliczanie masy molowej kwasu.
Zadania zamknięte (test wyboru) pozwalają na szybką ocenę wiedzy. Zadania otwarte wymagają głębszego zrozumienia tematu. Zastosujmy różne typy zadań, aby sprawdzić wiedzę uczniów kompleksowo.
W sprawdzianie można uwzględnić zadania praktyczne, np. identyfikacja kwasu za pomocą wskaźnika. Takie zadania angażują uczniów i pomagają im lepiej zrozumieć materiał.
Typowe błędy i jak ich unikać
Częstym błędem jest mylenie kwasów z zasadami. Wyraźnie rozróżniajmy te pojęcia. Wyjaśnijmy różnice w budowie, właściwościach i reakcjach.
Uczniowie często mają problem z nazewnictwem kwasów. Ćwiczmy nazewnictwo kwasów beztlenowych i tlenowych. Użyjmy kart pracy z różnymi wzorami kwasów do nazwania.
Kolejnym problemem jest nierozumienie reakcji zobojętniania. Pokażmy to na prostych przykładach, np. gaszenie zgagi za pomocą leków zobojętniających kwas solny w żołądku. Wyjaśnijmy, że w wyniku reakcji zobojętniania powstaje sól i woda.
Jak uatrakcyjnić lekcję?
Przeprowadźmy eksperymenty, np. reakcja kwasu solnego z magnezem. Reakcja z wydzielaniem gazu zawsze robi wrażenie. Zadbajmy o bezpieczeństwo i jasne instrukcje.
Wykorzystajmy prezentacje multimedialne z wizualizacjami. Pokażmy modele cząsteczek kwasów. Użyjmy animacji przedstawiających proces dysocjacji kwasu w wodzie.
Zastosujmy gry i quizy interaktywne. Wykorzystajmy platformy edukacyjne, np. Kahoot! lub Quizizz. Uczniowie chętniej się uczą, gdy nauka jest połączona z zabawą.
Zadawajmy pytania problemowe, np. "Dlaczego deszcz jest kwaśny?". Zachęcajmy uczniów do samodzielnego myślenia i poszukiwania odpowiedzi.
Pamiętajmy o powtórkach i utrwalaniu wiedzy. Regularne powtarzanie materiału pozwala na lepsze zapamiętanie informacji. Możemy wykorzystać krótkie kartkówki lub zadania domowe.
Uczniowie powinni zrozumieć, że chemia jest wszędzie wokół nas. Połączenie teorii z praktyką sprawi, że nauka będzie bardziej interesująca i efektywna. Powodzenia!