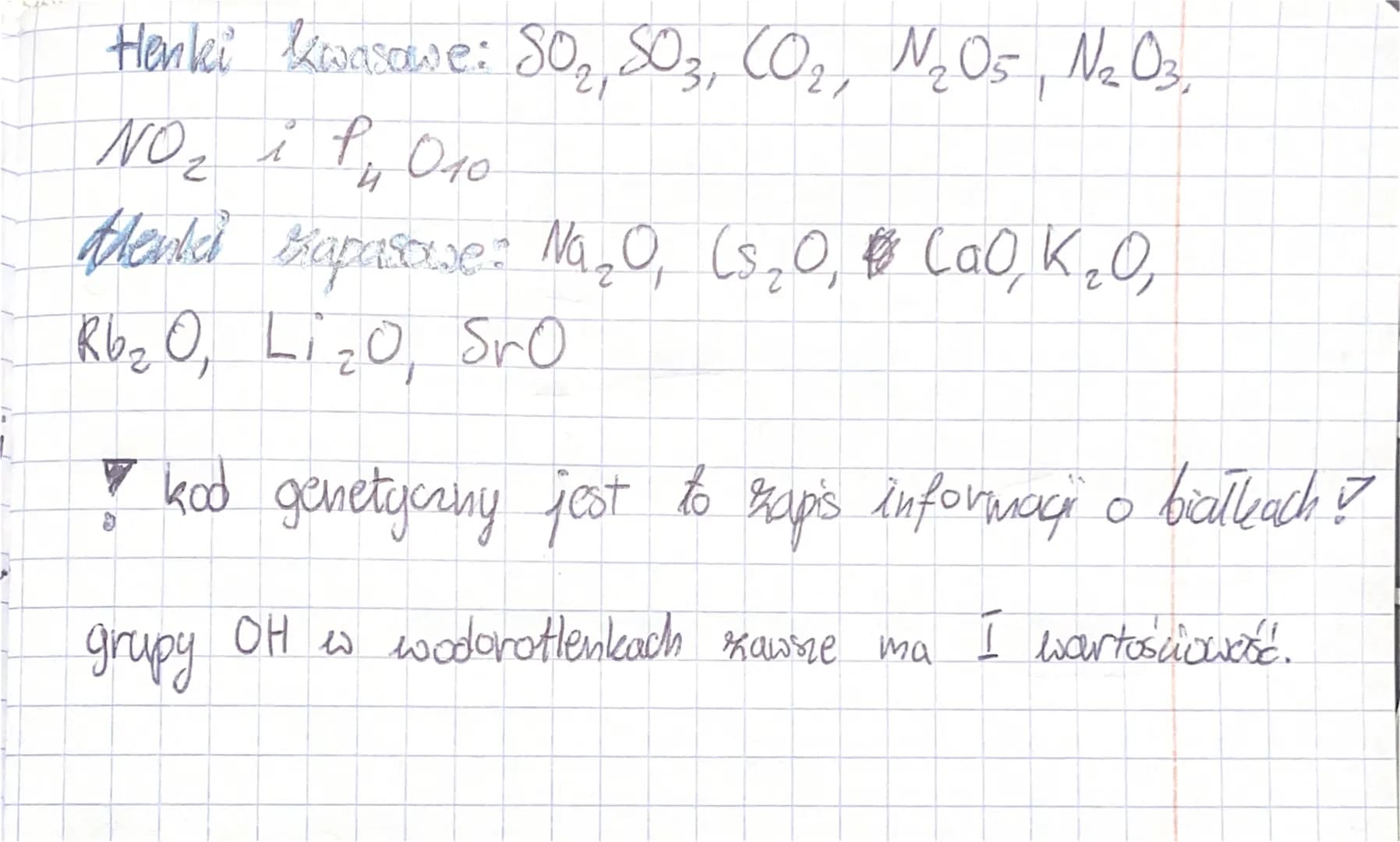Cześć! Przygotowujesz się do sprawdzianu z chemii? Super! Zajmiemy się teraz tematem, który często pojawia się na testach: Chemia Dział 1. Rozłożymy to na czynniki pierwsze, żeby wszystko było jasne i proste. Przygotuj się na dawkę wiedzy!
Czym jest "Chemia Dział 1"?
Chemia Dział 1 to zwykle wprowadzenie do chemii. Obejmuje podstawowe pojęcia, prawa i zasady, które są fundamentem całej nauki. Można to porównać do fundamentów domu – bez nich nic solidnego nie zbudujesz! Zazwyczaj ten dział skupia się na budowie materii, właściwościach substancji i podstawowych reakcjach chemicznych. Dlatego zrozumienie tych zagadnień jest bardzo ważne.
Podstawowe Pojęcia
Zacznijmy od podstawowych definicji. To od nich wszystko się zaczyna. Bez solidnej bazy słownictwa trudno będzie zrozumieć bardziej zaawansowane koncepcje. Zwróć uwagę na szczegóły, one często decydują o sukcesie.
Substancja: To każdy rodzaj materii o określonym składzie i właściwościach. Może to być woda (H₂O), sól kuchenna (NaCl) lub cukier (C₁₂H₂₂O₁₁). Substancje możemy podzielić na proste (pierwiastki) i złożone (związki chemiczne).
Mieszanina: Powstaje przez zmieszanie dwóch lub więcej substancji. Każda ze zmieszanych substancji zachowuje swoje właściwości. Przykładem jest powietrze (mieszanina azotu, tlenu i innych gazów) lub herbata z cukrem (mieszanina wody, herbacianego naparu i cukru). Mieszaniny dzielimy na jednorodne (np. roztwór soli w wodzie) i niejednorodne (np. piasek z wodą).
Pierwiastek: To substancja, której nie można rozłożyć na prostsze składniki za pomocą metod chemicznych. Przykładami są wodór (H), tlen (O) i żelazo (Fe). Pierwiastki są przedstawione w układzie okresowym pierwiastków.
Związek chemiczny: To substancja, która składa się z dwóch lub więcej pierwiastków połączonych ze sobą wiązaniami chemicznymi. Przykłady to woda (H₂O) i dwutlenek węgla (CO₂). Związki chemiczne mają określony skład i właściwości, które różnią się od właściwości pierwiastków, z których powstały.
Stany Skupienia Materii
Materię możemy spotkać w różnych stanach skupienia. Znasz je na pewno z życia codziennego. To, w jakim stanie jest dana substancja, zależy od temperatury i ciśnienia.
Stan stały: Substancje w stanie stałym mają określony kształt i objętość. Cząsteczki są ściśle upakowane i utrzymywane razem silnymi siłami. Przykładem jest lód, żelazo, czy drewno. Mają one wyraźną strukturę.
Stan ciekły: Substancje w stanie ciekłym mają określoną objętość, ale nie mają określonego kształtu – przyjmują kształt naczynia, w którym się znajdują. Cząsteczki są blisko siebie, ale mogą się przemieszczać. Przykładem jest woda, olej i alkohol.
Stan gazowy: Substancje w stanie gazowym nie mają określonego kształtu ani objętości – wypełniają całą dostępną przestrzeń. Cząsteczki są daleko od siebie i poruszają się bardzo szybko. Przykładem jest powietrze, para wodna i dwutlenek węgla. Gazy są bardzo ściśliwe.
Przemiany fazowe: To zmiany stanu skupienia. Na przykład, topnienie to przejście ze stanu stałego w ciekły (np. lód zamienia się w wodę). Wrzenie to przejście ze stanu ciekłego w gazowy (np. woda zamienia się w parę wodną). Sublimacja to przejście ze stanu stałego w gazowy z pominięciem stanu ciekłego (np. suchy lód). Kondensacja to przejście ze stanu gazowego w ciekły (np. para wodna zamienia się w wodę na zimnej szybie).
Budowa Atomu
Atomy to podstawowe jednostki materii. Składają się z mniejszych cząstek. Zrozumienie budowy atomu jest kluczowe do zrozumienia właściwości chemicznych pierwiastków.
Protony: Cząstki o ładunku dodatnim, znajdujące się w jądrze atomowym. Liczba protonów określa, jakim pierwiastkiem jest dany atom. Np. atom wodoru ma 1 proton, atom helu ma 2 protony, atom węgla ma 6 protonów. To one definiują pierwiastek.
Neutrony: Cząstki o ładunku obojętnym, znajdujące się w jądrze atomowym. Neutrony wpływają na masę atomu. Atomy tego samego pierwiastka mogą mieć różną liczbę neutronów – nazywamy je izotopami.
Elektrony: Cząstki o ładunku ujemnym, krążące wokół jądra atomowego. Elektrony znajdują się na określonych orbitalach (poziomach energetycznych). To elektrony biorą udział w tworzeniu wiązań chemicznych. To, jak bardzo atom chce oddawać lub przyjmować elektrony, determinuje jego reaktywność.
Liczba atomowa (Z): Określa liczbę protonów w jądrze atomowym. Jest to charakterystyczna cecha każdego pierwiastka. Liczba atomowa jest podana w układzie okresowym pierwiastków.
Liczba masowa (A): Określa sumę liczby protonów i neutronów w jądrze atomowym. Różnica między liczbą masową a liczbą atomową daje liczbę neutronów w atomie.
Układ Okresowy Pierwiastków
Układ okresowy pierwiastków to tabelaryczne zestawienie pierwiastków chemicznych. Uporządkowane są one według rosnącej liczby atomowej. Układ okresowy zawiera wiele informacji o każdym pierwiastku, np. symbol, nazwę, liczbę atomową, masę atomową.
Grupy: Pionowe kolumny w układzie okresowym. Pierwiastki w tej samej grupie mają podobne właściwości chemiczne. Wynika to z podobnej konfiguracji elektronów walencyjnych (elektronów na ostatniej powłoce elektronowej).
Okresy: Poziome rzędy w układzie okresowym. W obrębie okresu właściwości pierwiastków zmieniają się stopniowo. Wraz ze wzrostem liczby atomowej, zmieniają się właściwości metaliczne, niemetaliczne i reaktywność.
Wiązania Chemiczne
Wiązania chemiczne to siły, które utrzymują atomy razem w cząsteczkach i kryształach. Bez wiązań chemicznych nie byłoby związków chemicznych, a więc i większości rzeczy, które nas otaczają.
Wiązanie jonowe: Powstaje między atomami, które znacznie różnią się elektroujemnością. Polega na przekazaniu elektronu od jednego atomu do drugiego. Powstają jony o przeciwnych ładunkach, które przyciągają się elektrostatycznie. Przykładem jest chlorek sodu (NaCl). Metal oddaje elektron niemetalowi.
Wiązanie kowalencyjne: Powstaje między atomami, które mają zbliżoną elektroujemność. Polega na uwspólnieniu elektronów między atomami. Atomy dzielą się elektronami, tworząc stabilną strukturę. Przykładem jest woda (H₂O) i metan (CH₄).
Wiązanie metaliczne: Występuje w metalach. Polega na tym, że atomy metalu oddają swoje elektrony walencyjne do wspólnego "morza elektronowego". Elektrony te poruszają się swobodnie po całej strukturze metalu. Dzięki temu metale dobrze przewodzą prąd i ciepło.
Reakcje Chemiczne
Reakcja chemiczna to proces, w którym jedne substancje (reagenty) przekształcają się w inne substancje (produkty). Podczas reakcji chemicznej następuje zerwanie i tworzenie wiązań chemicznych. Reakcje chemiczne można opisać za pomocą równań chemicznych.
Reagenty: Substancje, które biorą udział w reakcji chemicznej. Są zapisywane po lewej stronie równania reakcji.
Produkty: Substancje, które powstają w wyniku reakcji chemicznej. Są zapisywane po prawej stronie równania reakcji.
Równanie chemiczne: Zapis reakcji chemicznej za pomocą symboli i wzorów chemicznych. Równanie chemiczne musi być zbilansowane, tzn. liczba atomów każdego pierwiastka musi być taka sama po obu stronach równania. Balansowanie równań chemicznych to kluczowa umiejętność. Pamiętaj o bilansie ładunków.
Dzięki temu opracowaniu, Twój sprawdzian z chemii – Dział 1 będzie łatwiejszy. Powodzenia!