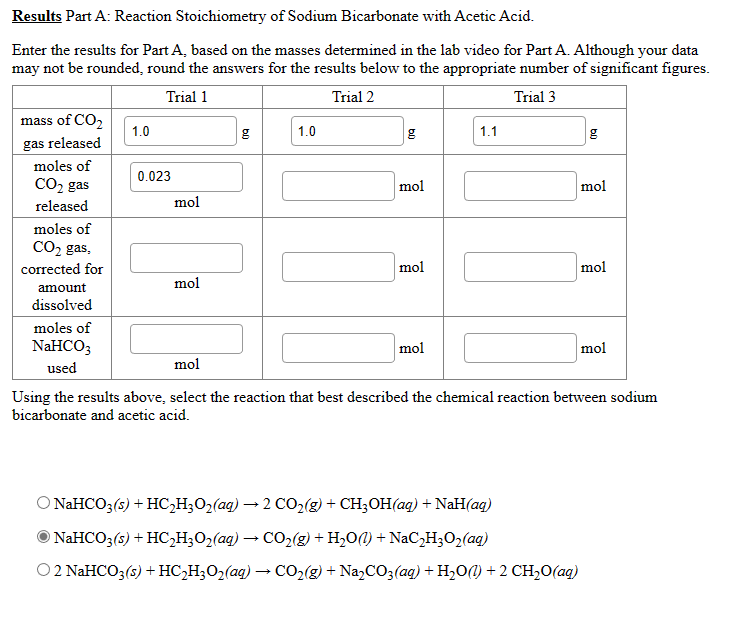
Rozdział 9, Sekcja 2 Stechiometria, może stanowić wyzwanie dla uczniów.
Kluczowe Koncepcje i Odpowiedzi
Analizujemy kluczowe koncepcje. Omawia również typowe błędy.
Stechiometria odnosi się do ilościowych relacji. Są one pomiędzy reagentami i produktami w reakcjach chemicznych.
Sekcja 2 prawdopodobnie koncentruje się na obliczeniach. Obliczenia dotyczą ilości reagentów i produktów.
Uczniowie powinni rozumieć stosunki molowe. Są one kluczowe do poprawnego rozwiązywania zadań.
Upewnij się, że uczniowie potrafią poprawnie wyważać równania chemiczne. Niezrównoważone równanie prowadzi do błędnych wyników.
Odpowiedzi do zadań z sekcji 2 stanowią tylko punkt odniesienia. Ważniejsze jest zrozumienie procesu rozwiązywania.
Typowe Zadania
Zadania często dotyczą konwersji masy na mole i odwrotnie.
Inne typowe zadania obejmują obliczanie wydajności teoretycznej.
Problemy z reagentami ograniczającymi również są powszechne.
Zadania mogą również wymagać obliczenia procentowej wydajności reakcji.
Wskazówki dla Nauczycieli
Oto kilka wskazówek, jak skutecznie uczyć tego materiału.
Zacznij od powtórki podstawowych pojęć. Pojęcia to masa molowa i pojęcie mola.
Wykorzystaj analogie z życia codziennego. Wyjaśnij stosunki stechiometryczne.
Pokaż uczniom, jak wyprowadzić stosunki molowe z zrównoważonego równania.
Podkreśl znaczenie jednostek w obliczeniach. Zwróć uwagę na poprawne zaokrąglanie wyników.
Rozwiąż kilka przykładowych zadań na tablicy. Wyjaśnij każdy krok szczegółowo.
Zachęcaj uczniów do zadawania pytań. Rozwiej wątpliwości na bieżąco.
Zadawaj zadania o różnym stopniu trudności. Dostosuj poziom do umiejętności uczniów.
Wykorzystaj ćwiczenia praktyczne w laboratorium. Demonstrują zasad stechiometrii.
Najczęstsze Błędy Uczniów
Uczniowie często popełniają te same błędy. Warto je omówić.
Niezrównoważone równania chemiczne to częsty problem.
Niepoprawne konwersje jednostek prowadzą do błędnych wyników.
Uczniowie mylą wydajność teoretyczną z wydajnością rzeczywistą.
Niewłaściwe identyfikowanie reagenta ograniczającego.
Zaokrąglanie wyników na zbyt wczesnym etapie obliczeń.
Zapominanie o uwzględnieniu współczynników stechiometrycznych.
Błędne obliczanie masy molowej związków.
Uatrakcyjnienie Nauki
Istnieją sposoby, aby nauka stechiometrii była bardziej interesująca.
Wykorzystaj wizualizacje. Pomogą zobrazować reakcje chemiczne.
Zastosuj interaktywne symulacje online. Uczniowie mogą eksperymentować w wirtualnym laboratorium.
Pokaż filmy wideo z doświadczeń chemicznych. Doświadczenia te ilustrują zasady stechiometrii.
Zadawaj zadania problemowe, które są związane z życiem codziennym. Na przykład obliczanie ilości składników do upieczenia ciasta.
Organizuj konkursy rozwiązywania zadań. Nagradzaj uczniów za poprawne odpowiedzi.
Wykorzystaj gry edukacyjne. Gry pomogą w utrwaleniu wiedzy w zabawny sposób.
Zorganizuj demonstracje chemiczne. Demonstracje, które wizualnie ilustrują stosunki stechiometryczne.
Pracuj w małych grupach. Wspólne rozwiązywanie problemów ułatwia zrozumienie.
Korzystaj z różnych metod nauczania. Dostosuj je do indywidualnych potrzeb uczniów.
Przykładowe Zadanie i Rozwiązanie
Rozważmy reakcję: 2H2 + O2 → 2H2O.
Jeżeli mamy 4 gramy wodoru, ile gramów tlenu potrzeba do całkowitej reakcji?
Krok 1: Oblicz liczbę moli wodoru.
Masa molowa H2 = 2 g/mol. 4 g / 2 g/mol = 2 mole H2.
Krok 2: Określ stosunek molowy H2 do O2. Ze zrównoważonego równania wynosi on 2:1.
Krok 3: Oblicz liczbę moli O2 potrzebnych do reakcji. 2 mole H2 / 2 = 1 mol O2.
Krok 4: Oblicz masę tlenu. Masa molowa O2 = 32 g/mol. 1 mol * 32 g/mol = 32 gramy O2.
Odpowiedź: Potrzeba 32 gramów tlenu do całkowitej reakcji z 4 gramami wodoru.
Podsumowanie
Opanowanie stechiometrii wymaga solidnych podstaw. Potrzebne jest również praktyczne doświadczenie.
Skup się na zrozumieniu koncepcji, a nie tylko na zapamiętywaniu wzorów.
Wykorzystaj różnorodne metody nauczania. Pomogą one uczniom w przyswojeniu wiedzy.
Bądź cierpliwy i zachęcaj uczniów do zadawania pytań. To klucz do sukcesu.
Pamiętaj, że kluczem do sukcesu jest praktyka. Regularna praktyka i rozwiązywanie zadań.