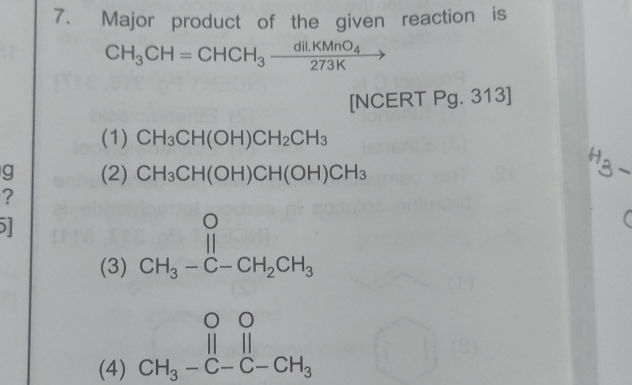
Chemia organiczna potrafi być trudna, ale nie musi! Rozłóżmy razem pewną reakcję: CH3CH(OH)CH3 z KMnO4 i H2SO4. Spróbujemy zrozumieć, co się tutaj dzieje, krok po kroku.
Czym są te związki?
Pierwszy związek to CH3CH(OH)CH3. To nic innego jak alkohol! Dokładniej, jest to propan-2-ol, znany też jako alkohol izopropylowy. Alkohol izopropylowy to popularny środek dezynfekujący i składnik płynów do odkażania.
Kolejny to KMnO4, czyli manganian(VII) potasu. To silny utleniacz. Wyobraź sobie, że "kradnie" elektrony od innych substancji. W laboratorium manganian(VII) potasu ma wiele zastosowań, na przykład w reakcjach utleniania.
Ostatni to H2SO4, czyli kwas siarkowy. Działa jako katalizator i zakwasza środowisko reakcji. Kwas siarkowy to bardzo silny kwas, obecny np. w akumulatorach samochodowych. Ale w tej reakcji pomaga w prawidłowym przebiegu procesu.
Definicje: Utlenianie i Redukcja
Żeby zrozumieć tę reakcję, musimy wiedzieć, co to utlenianie i redukcja. Utlenianie to proces, w którym substancja traci elektrony. Redukcja to proces, w którym substancja zyskuje elektrony. Zawsze idą one w parze: ktoś musi oddać, żeby ktoś inny mógł przyjąć!
Reakcja
W tej reakcji, propan-2-ol (CH3CH(OH)CH3) ulega utlenieniu. Manganian(VII) potasu (KMnO4) jest utleniaczem, czyli powoduje to utlenienie. Kwas siarkowy (H2SO4) pomaga w reakcji, dostarczając kwaśnego środowiska.
Co się dzieje z propan-2-olem? Grupa hydroksylowa (-OH) przy środkowym węglu ulega utlenieniu. Przekształca się w grupę karbonylową (C=O).
Produktem utleniania propan-2-olu jest propanon (CH3COCH3), znany też jako aceton. Aceton to popularny rozpuszczalnik, na przykład do zmywania lakieru do paznokci.
Jak to zapisać?
Równanie reakcji wygląda następująco:
CH3CH(OH)CH3 + KMnO4 + H2SO4 → CH3COCH3 + inne produkty.
Oczywiście, równanie trzeba zbilansować, ale skupmy się na głównych produktach.
Co się dzieje z KMnO4?
Manganian(VII) potasu (KMnO4) jest utleniaczem. On się redukuje, czyli przyjmuje elektrony. Atom manganu w KMnO4 ma stopień utlenienia +7. Podczas reakcji zmienia swój stopień utlenienia, zwykle do +2 lub +4. To zależy od warunków reakcji.
W środowisku kwaśnym (dzięki H2SO4), manganian(VII) potasu redukuje się zwykle do jonów manganu(II) (Mn2+). Jony manganu(II) są bezbarwne lub lekko różowe. To wyjaśnia, dlaczego roztwór z KMnO4 traci swój fioletowy kolor podczas reakcji.
Zatem, KMnO4 oddaje swój "ładunek" utleniający, powodując utlenienie propan-2-olu do acetonu. Sam redukuje się, zmieniając swój stopień utlenienia i kolor.
Rola kwasu siarkowego (H2SO4)
Kwas siarkowy (H2SO4) pełni rolę katalizatora i dostarcza jonów wodorowych (H+). Jony wodorowe zakwaszają środowisko reakcji. To sprzyja utlenianiu alkoholi przez manganian(VII) potasu.
Kwas siarkowy nie wchodzi bezpośrednio w reakcję utleniania-redukcji. Zapewnia odpowiednie warunki, aby reakcja przebiegała sprawniej. Działa jak "pomocnik", który przyspiesza cały proces.
Podsumowanie
Podsumowując, w reakcji propan-2-olu (CH3CH(OH)CH3) z manganianem(VII) potasu (KMnO4) w obecności kwasu siarkowego (H2SO4):
- Propan-2-ol ulega utlenieniu do propanonu (acetonu).
- Manganian(VII) potasu ulega redukcji (zmienia stopień utlenienia manganu, zazwyczaj z +7 na +2) i traci fioletowy kolor.
- Kwas siarkowy katalizuje reakcję, dostarczając kwaśnego środowiska.
Pamiętaj! Kluczem do zrozumienia chemii organicznej jest rozkładanie skomplikowanych reakcji na mniejsze, zrozumiałe części. Ćwicz, a z czasem wszystko stanie się prostsze!