Hej! Witajcie na naszym powtórkowym maratonie z budowy atomu. Razem przygotujemy się do sprawdzianu z Nowej Ery. Damy radę!
Podstawowe Pojęcia
Zacznijmy od podstaw. Czym jest atom?
Atom to podstawowy składnik materii. Jest niepodzielny chemicznie. Przynajmniej w tradycyjnym sensie.
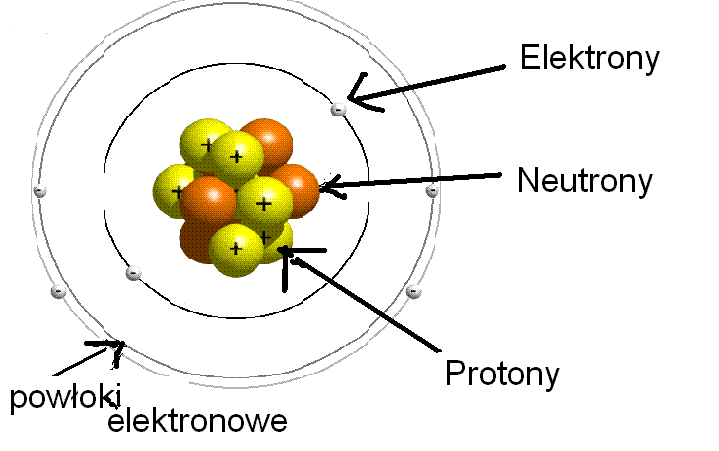
Atom składa się z:
- Jądra atomowego
- Elektronów
Jądro Atomowe
Jądro atomowe znajduje się w centrum atomu. Jest bardzo małe i gęste.
Składa się z:
- Protonów
- Neutronów
Protony mają ładunek dodatni (+). Ich liczba atomowa (Z) identyfikuje pierwiastek.
Neutrony są elektrycznie obojętne. Ich liczba wpływa na masę atomową (A).
Liczba atomowa (Z) to liczba protonów w jądrze atomowym. Jest unikalna dla każdego pierwiastka.
Liczba masowa (A) to suma liczby protonów i neutronów w jądrze atomowym.
Elektrony
Elektrony krążą wokół jądra atomowego. Mają ładunek ujemny (-).
Liczba elektronów w atomie obojętnym jest równa liczbie protonów.
Elektrony poruszają się po orbitalach, tworząc powłoki elektronowe.
Kolejne powłoki oznacza się literami: K, L, M, N, O, P, Q.
Każda powłoka może pomieścić określoną liczbę elektronów. Obliczamy to ze wzoru: 2n2, gdzie n to numer powłoki.
Powłoka K (n=1) może pomieścić 2 elektrony.
Powłoka L (n=2) może pomieścić 8 elektronów.
I tak dalej...
Konfiguracja Elektronowa
Konfiguracja elektronowa to rozmieszczenie elektronów na powłokach elektronowych.
Określa właściwości chemiczne pierwiastka.
Elektrony walencyjne to elektrony znajdujące się na ostatniej powłoce (powłoce walencyjnej).
To one biorą udział w tworzeniu wiązań chemicznych.
Atomy dążą do uzyskania oktetu elektronowego (8 elektronów na ostatniej powłoce) lub dubletu (2 elektrony dla helu).
Dlatego atomy łączą się ze sobą, tworząc związki chemiczne.
Izotopy
Izotopy to atomy tego samego pierwiastka, które mają różną liczbę neutronów.
Mają taką samą liczbę atomową (Z), ale różną liczbę masową (A).
Na przykład: węgiel-12 i węgiel-14 są izotopami węgla.
Węgiel-12 ma 6 protonów i 6 neutronów.
Węgiel-14 ma 6 protonów i 8 neutronów.
Promieniotwórczość
Niektóre izotopy są promieniotwórcze. Oznacza to, że ich jądra są niestabilne i ulegają rozpadowi.
Podczas rozpadu emitowane jest promieniowanie: alfa, beta, gamma.
Promieniowanie alfa (α) to strumień jąder helu (4He). Ma małą przenikliwość.
Promieniowanie beta (β) to strumień elektronów lub pozytonów. Ma większą przenikliwość niż promieniowanie alfa.
Promieniowanie gamma (γ) to promieniowanie elektromagnetyczne o bardzo krótkiej długości fali. Ma bardzo dużą przenikliwość.
Okres półtrwania to czas, po którym połowa atomów danego izotopu promieniotwórczego ulegnie rozpadowi.
Zadania Przykładowe
Spróbujmy rozwiązać kilka zadań.
1. Jaki to pierwiastek, jeśli ma 11 protonów?
Odpowiedź: Sód (Na). Sprawdzamy w układzie okresowym!
2. Ile neutronów ma atom tlenu-16?
Odpowiedź: Tlen ma liczbę atomową 8 (8 protonów). Liczba masowa wynosi 16. Zatem liczba neutronów to 16 - 8 = 8.
3. Napisz konfigurację elektronową potasu (K). Potas ma 19 elektronów.
Odpowiedź: K: 1s2 2s2 2p6 3s2 3p6 4s1 lub krócej K: [Ar] 4s1
Podsumowanie
Pamiętajcie:
- Atom to podstawowy składnik materii.
- Jądro atomowe zawiera protony i neutrony.
- Elektrony krążą wokół jądra na powłokach elektronowych.
- Liczba atomowa (Z) to liczba protonów.
- Liczba masowa (A) to liczba protonów i neutronów.
- Izotopy to atomy tego samego pierwiastka o różnej liczbie neutronów.
- Niektóre izotopy są promieniotwórcze.
Powodzenia na sprawdzianie! Wierzę w Was!