Zaczynamy naszą podróż po świecie atomów! Dowiemy się, z czego są zbudowane i jak rozmieszczone są w nich elektrony. To podstawa chemii, więc skupmy się i ruszajmy!
Budowa Atomu
Atom to podstawowy składnik materii. Jest niezwykle mały! Składa się z jeszcze mniejszych cząstek.
W centrum atomu znajduje się jądro atomowe. Jądro składa się z protonów i neutronów. Protony mają ładunek dodatni. Neutrony są elektrycznie obojętne.
Dookoła jądra krążą elektrony. Mają one ładunek ujemny. Elektrony poruszają się w określonych obszarach wokół jądra.
Protony, Neutrony i Elektrony – Kluczowe Cząstki
Protony decydują o tym, jaki to pierwiastek. Liczba protonów w jądrze to liczba atomowa (Z). Każdy pierwiastek ma unikalną liczbę atomową. Na przykład, wodór (H) ma liczbę atomową 1, a tlen (O) ma liczbę atomową 8.
Neutrony wpływają na masę atomu. Atomy tego samego pierwiastka mogą mieć różną liczbę neutronów. Takie atomy nazywamy izotopami. Na przykład, węgiel-12 i węgiel-14 to izotopy węgla.
Elektrony odpowiadają za właściwości chemiczne atomu. Decydują, jak atom będzie reagował z innymi atomami. Ich rozmieszczenie wokół jądra jest bardzo ważne.
Konfiguracja Elektronowa
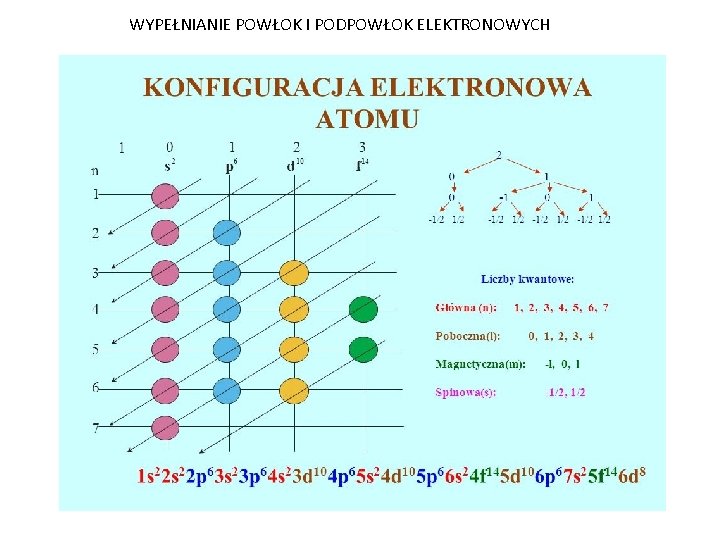
Konfiguracja elektronowa to sposób rozmieszczenia elektronów w atomie. Elektrony zajmują określone powłoki elektronowe wokół jądra. Powłoki oznaczamy numerami: 1, 2, 3 itd. (lub literami K, L, M itd.).
Każda powłoka może pomieścić określoną liczbę elektronów. Pierwsza powłoka (K) może pomieścić maksymalnie 2 elektrony. Druga powłoka (L) – 8 elektronów. Trzecia powłoka (M) – 18 elektronów, i tak dalej.
Elektrony najpierw zapełniają powłoki położone bliżej jądra. Dopiero po zapełnieniu pierwszej powłoki, elektrony zaczynają zajmować drugą powłokę.
Zapis Konfiguracji Elektronowej
Konfigurację elektronową zapisujemy, podając numer powłoki i liczbę elektronów na tej powłoce. Na przykład, konfiguracja elektronowa wodoru (H) to 1s1. Oznacza to, że wodór ma 1 elektron na powłoce 1s.
Konfiguracja elektronowa tlenu (O) to 1s2 2s2 2p4. Oznacza to, że tlen ma 2 elektrony na powłoce 1s, 2 elektrony na powłoce 2s i 4 elektrony na powłoce 2p.
Orbital to obszar wokół jądra, w którym z największym prawdopodobieństwem można znaleźć elektron. Orbitale s mają kształt kulisty, orbitale p – kształt hantli.
Reguła Hunda i Zakaz Pauliego
Reguła Hunda mówi, że elektrony najpierw zajmują wszystkie orbitale o tej samej energii pojedynczo, zanim zaczną się łączyć w pary. Na przykład, jeśli mamy 3 elektrony do umieszczenia na trzech orbitalach p, to każdy elektron zajmie oddzielny orbital p.
Zakaz Pauliego mówi, że na jednym orbitalu mogą znajdować się maksymalnie dwa elektrony, ale muszą mieć przeciwne spiny. Spin to wewnętrzna właściwość elektronu, którą można sobie wyobrazić jako jego ruch obrotowy.
Przykłady Konfiguracji Elektronowych
Spójrzmy na kilka przykładów, aby lepiej zrozumieć konfigurację elektronową. Sód (Na) ma liczbę atomową 11. Jego konfiguracja elektronowa to 1s2 2s2 2p6 3s1.
Chlor (Cl) ma liczbę atomową 17. Jego konfiguracja elektronowa to 1s2 2s2 2p6 3s2 3p5.
Argon (Ar) ma liczbę atomową 18. Jego konfiguracja elektronowa to 1s2 2s2 2p6 3s2 3p6. Zauważ, że argon ma wszystkie powłoki elektronowe zapełnione. To czyni go gazem szlachetnym, bardzo niereaktywnym.
Zastosowania Konfiguracji Elektronowej
Znajomość konfiguracji elektronowej jest kluczowa do zrozumienia właściwości chemicznych pierwiastków. Pomaga przewidzieć, jak atomy będą reagować ze sobą i jakie związki będą tworzyć.
Konfiguracja elektronowa jest wykorzystywana w wielu dziedzinach nauki i technologii. Na przykład, w chemii organicznej, pozwala zrozumieć mechanizmy reakcji. W fizyce ciała stałego, pomaga zrozumieć właściwości materiałów.
W medycynie, konfiguracja elektronowa jest ważna w radioterapii. Pomaga zrozumieć, jak promieniowanie jonizujące oddziałuje z atomami w komórkach nowotworowych.
Mam nadzieję, że ten artykuł pomógł Ci zrozumieć budowę atomu i konfigurację elektronową. To fascynujący świat, który warto poznawać dalej!